Phản ứng nhiệt phân: 2Al(OH)3 → Al2O3 + 3H2O - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng nhiệt phân Al(OH)3 một cách dễ dàng với đầy đủ điều kiện.
Phản ứng nhiệt phân: 2Al(OH)3 → Al2O3 + 3H2O - Cân bằng phương trình hóa học
Phản ứng nhiệt phân:
2Al(OH)3 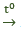
Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
Cách thực hiện phản ứng
- Cho chất rắn Al(OH)3 nhiệt phân.
Hiện tượng nhận biết phản ứng
- Dung dịch keo trắng nhôm hidroxit (Al(OH)3) chuyển thành chất rắn màu trắng nhôm oxit (Al2O3).
Bạn có biết
- Tương tự Al(OH)3 một số bazơ khác như Cu(OH)2; Al(OH)3,… cũng bị nhiệt phân hủy cho oxit và nước. Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.

Ví dụ minh họa
Ví dụ 1: Cho 4 chất sau: Al, AlCl3, Al(OH)3, Al2O3. Hãy sắp xếp 4 chất này thành 1 dãy biến hóa (gồm 4 chất)?
A. Al → AlCl3 → Al(OH)3 → Al2O3.
B. Al(OH)3 → Al → AlCl3 → Al2O3.
C. Al2O3 → Al(OH)3 → Al → AlCl3.
D. AlCl3 → Al2O3 → Al → Al(OH)3.
Hướng dẫn giải
Chọn A.
2Al + 3Cl2 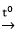
AlCl3 + NaOH → Al(OH)3 + 3NaCl
2Al(OH)3 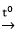
Ví dụ 2: Nhôm hidroxit (Al(OH)3) là hợp chất không bền với nhiệt, khi đun nóng bị phân hủy thành:
A. H2O và Al.
B. H2O và Al2O3.
C. H2 và Al2O3.
D. O2 và AlH3.
Hướng dẫn giải
Chọn B.
2Al(OH)3 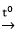
Ví dụ 3:Nung 15,6 gam Al(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được m gam một oxit. Giá trị của m là:
A. 20,4.
B. 15,3.
C. 10,2.
D. 5,1.
Hướng dẫn giải
Chọn C.
2Al(OH)3 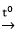
⇒ nAl2O3=0,1 mol ⇒ mAl2O3=0,1.102=10,2 gam


