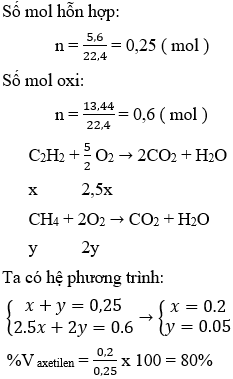2C2H2 + 5O2 → 4CO2 + 2H2O - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học C2H2 + O2 một cách dễ dàng với đầy đủ điều kiện.
2C2H2 + 5O2 → 4CO2 + 2H2O - Cân bằng phương trình hóa học
Phản ứng hóa học:
2C2H2 + 5O2 
Điều kiện phản ứng
- Nhiệt độ cao.
Cách thực hiện phản ứng
- Đốt cháy axetilen trong oxi ở điều kiện nhiệt độ cao.
Hiện tượng nhận biết phản ứng
- Khi đốt cháy axetilen trong oxi ở điều kiện nhiệt độ cao thì thấy có khí không màu thoát ra (CO2).
Bạn có biết
- Phản ứng trên là phản ứng oxi hóa hoàn toàn.
- Phản ứng cháy của axetilen tỏa nhiều nhiệt.
- Số mol CO2 > H2O và số mol ankin phản ứng bằng hiệu số mol của CO2 và H2O.

Ví dụ minh họa
Ví dụ 1: Đốt cháy hoàn toàn 5,6 lít hỗn hợp metan và axetilen cần 13,44 lít oxi. Phần trăm thể tích axetilen trong hỗn hợp là?
A. 20%
B. 40%
C. 60%
D. 80%
Hướng dẫn:
Đáp án D
Ví dụ 2: Đốt cháy hoàn toàn khí axetilen rồi sục hỗn hợp khí thu được qua dung dịch nước vôi trong. Hiện tượng thu được là gì?
A. Kết tủa trắng
B. Có khí thoát ra
C. Không có hiện tượng
D. Dung dịch nước vôi có màu vàng
Hướng dẫn:
2C2H2 + 5O2 → 4CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Đáp án A
Ví dụ 3: Ứng dụng trong phản ứng cháy của axetilen dùng để làm gì?
A. Làm nguyên liệu sản xuất trong công nghiệp
B. Làm dung môi
C. Hàn cắt kim loại
D. Không có ứng dụng
Hướng dẫn: Vì phản ứng cháy của axetilen tỏa nhiều nhiệt nên được sử dụng trong các đèn xì để hàn cắt kim loại.
Đáp án C.