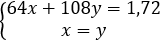2Ag + S → Ag2S - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học Ag + S một cách dễ dàng với đầy đủ điều kiện.
2Ag + S → Ag2S - Cân bằng phương trình hóa học
Phản ứng hóa học:
2Ag + S → Ag2S
Điều kiện phản ứng
- Không có điều kiện
Cách thực hiện phản ứng
- Cho kim loại bạc tác dụng với lưu huỳnh
Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa màu đen
Bạn có biết

Ví dụ minh họa
Ví dụ 1: Trong các phản ứng sau đây phản ứng nào tạo kết tủa màu đen ?
A. 2Ag + I2 → 2AgI ↓
B. 2Ag + Br2 → 2AgBr ↓
C. 2Ag + Cl2 → 2AgCl ↓
D. 2Ag + S → Ag2S ↓
Đáp án: D
Ví dụ 2: Cho 10,8 g bạc tác dụng với 3,2 g lưu huỳnh thì thu được m g kết tủa . Gía trị của m là:
A. 9,92g B. 6,2g
C. 12,4 g D. 14,88 g
Hướng dẫn:
2Ag + S → Ag2S ↓
Ta có: nAg = 10,8/108 = 0,1 mol; nS = 3,2/32 = 0,1 mol
Theo phương trình: nS = 1/2 . nAg = 1/2 . 0,1 = 0,05 mol < 0,1 mol → nS dư
→ nAg2S = nAg = 0,05 mol → mAg2S = 0,05.248 = 12,4 g
Đáp án: C
Ví dụ 3: Cho 1,72 g hỗn hợp kim loại X gồm Cu , Ag( theo tỉ lệ mol 1:1) tác dụng với lưu huỳnh thì thu được a g kết tủa . Giá trị của a là:
A. 1,43g B. 2,2g
C. 1,7 g D. 2,96 g
Hướng dẫn:
Đặt x = nCu mol; y = nAg mol
Theo bài ra ta có:
→ x = y = 0,01 mol
2Ag + S → Ag2S ↓ (1)
0,01 mol → 0,005 mol
Cu + S → CuS ↓ (2)
0,01 mol → 0,01 mol
→ a = mAg2S + mCuS = 0,005.248 + 0,01.96 = 2,2 g
Đáp án: B