2Li + I2 → 2LiI - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học Li + I một cách dễ dàng với đầy đủ điều kiện.
2Li + I2 → 2LiI - Cân bằng phương trình hóa học
Phản ứng hóa học:
2Li + I2 → 2LiI
Điều kiện phản ứng
- Nhiệt độ >1000C
Cách thực hiện phản ứng
- Cho Li tác dụng với iot thu được muối Litiiotua.
Hiện tượng nhận biết phản ứng
Liti nóng chảy cháy sáng trong iot tạo thành muối màu đen.
Bạn có biết
Liti có tính khử rất mạnh, tham gia phản ứng với halogen (Cl2; Br2,…) phản ứng tỏa nhiều nhiệt tạo thành muối.
Ví dụ minh họa
Ví dụ 1: Cho 0,7 g kim kiềm M tác dụng vừa đủ với 12,7 g iot đun nóng. Kim loại M là
A. Li B. Na C. K D. Rb
Đáp án: A
Hướng dẫn giải:
Phương trình phản ứng: 2M + I2 → 2MI
nM = 2.nI2 = 2. 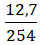
Ví dụ 2: Muốn bảo quản kim loại kiềm, người ta ngâm kín chúng trong chất nào?
A. Nước tinh khiết
B. Dung dịch H2SO4
C. Dung dịch KOH
D. Dầu hỏa
Đáp án: D
Hướng dẫn giải:
Vì Kim loại kiềm không phản ứng với dầu hỏa
Ví dụ 3: Kim loại kiềm là kim loại
A. Có lớp vỏ ngoài cùng chứa 1 e
B. Đứng đầu mỗi chu kì (trừ chu kì 1)
C. Có tính khử rất mạnh
D. Tất cả đều đúng
Đáp án: D



