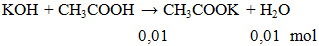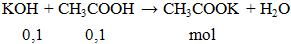KOH + CH3COOH → CH3COOK + H2O - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học KOH + CH3COOH một cách dễ dàng với đầy đủ điều kiện.
KOH + CH3COOH → CH3COOK + H2O - Cân bằng phương trình hóa học
Phản ứng hóa học:
KOH + CH3COOH → CH3COOK + H2O
Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ từ từ KOH vào ống nghiệm chứa CH3COOH và một mẩu quỳ tím.
Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ có màu đỏ, sau khi nhỏ KOH mẩu quỳ mất màu đỏ, dư KOH mẩu quỳ chuyển sang màu xanh.
Bạn có biết
- Các axit hữu cơ khác như HCOOH, C2H5COOH… cũng phản ứng với KOH tương tự axit axetic.
- Phản ứng giữa KOH và CH3COOH là phản ứng trung hòa.

Ví dụ minh họa
Ví dụ 1:
Phản ứng nào sau đây là phản ứng trung hòa?
A. 2KOH + CO2 → K2CO3 + H2O
B. KOH + SO2 → KHSO3
C. KOH + CH3COOH → CH3COOK + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Hướng dẫn giải
Phản ứng trung hòa là phản ứng KOH + CH3COOH → CH3COOK + H2O
Đáp án C.
Ví dụ 2:
Cho 100ml CH3COOH 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g. B. 0,98g. C. 0,754g. D. 1,10g.
Hướng dẫn giải
mmuối = 0,01.98 = 0,98 gam.
Đáp án B.
Ví dụ 3:
Cho 0,1 mol KOH phản ứng vừa đủ với 100ml CH3COOH aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 1.
Hướng dẫn giải
a = 0,1 : 0,1 = 1M.
Đáp án D.