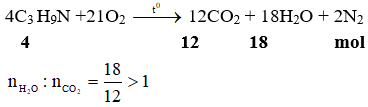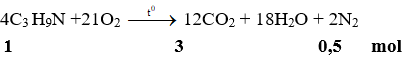4C3H9N + 21O2 12CO2 + 18H2O + 2N2 - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học 4C3H9N +21O2 một cách dễ dàng với đầy đủ điều kiện.
4C3H9N + 21O2 
-
Phản ứng hóa học:
4C3H9N + 21O2
12CO2 + 18H2O + 2N2
Điều kiện phản ứng
- Đốt cháy.
Cách thực hiện phản ứng
- Đốt cháy isopropylamin trong không khí, sau phản ứng thu được khí CO2, N2 và hơi nước.
Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra làm vần đục nước vôi trong.
Bạn có biết
- Tương tự isopropylamin, các amin khi bị đốt đều cháy và tỏa nhiều nhiệt.
- Khi đốt cháy isopropylamin, số mol H2O thu được sau phản ứng luôn lớn hơn số mol CO2.

-
Ví dụ minh họa
Ví dụ 1: Khi đốt cháy isopropylamin thu được H2O và CO2 với tỷ lệ số mol là
A. > 1. B. < 1.
C. = 1. D. không xác định được.
Hướng dẫn:
Đáp án: A
Ví dụ 2: Nhận định nào sau đây là sai?
A. isopropylamin khi bị đốt cháy và tỏa nhiều nhiệt.
B. Đốt cháy isopropylamin, sau phản ứng thu được khí CO2 và hơi nước.
C. đốt cháy isopropylamin, số mol H2O thu được luôn lớn hơn số mol CO2.
D. Khi đốt cháy hoàn toàn etyl amin, sản phẩm thu được làm đục nước vôi trong.
Hướng dẫn: Đốt cháy isopropylamin, sau phản ứng thu được khí CO2, N2 và hơi nước.
Đáp án: B
Ví dụ 3: Đốt cháy 1 mol khí isopropylamin trong không khí, sau phản ứng thu được khí CO2 và N2 có tổng số mol là
A. 1. B. 3.5.
C. 1,5. D. 2,5.
Hướng dẫn:
Đáp án: B