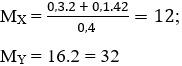C4H8 + H2 | CH3-CH=CH–CH3 + H2 → CH3–CH2–CH2–CH3 - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học C4H8 + H2 một cách dễ dàng với đầy đủ điều kiện.
C4H8 + H2 | CH3-CH=CH–CH3 + H2 → CH3–CH2–CH2–CH3 - Cân bằng phương trình hóa học
-
Phản ứng hóa học:
CH3-CH=CH–CH3 + H2
CH3–CH2–CH2–CH3
Điều kiện phản ứng
- Đun nóng, xúc tác niken (hoặc platin hoặc palađi).
Cách thực hiện phản ứng
- Đun nóng hỗn hợp but-2-en và H2 với xúc tác niken, but -2-en kết hợp với H2 thành butan (C4H10).
Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra không làm mất màu dung dịch brom.
Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Tỉ lệ phản ứng luôn là 1:1
- Khối lượng trước và sau phản ứng luôn bằng nhau
- Số mol sau phản ứng luôn giảm → Số mol H2 phản ứng = nđ - ns

-
Ví dụ minh họa
Ví dụ 1: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol but – 2 – en. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol
B. 0,2 mol
C. 0,25 mol
D. 0,3 mol
Hướng dẫn:
Ta có:
nX. MX = nY. MY
⇔ 0,4.12 = nY.32
⇒ nY = 0,15 mol
⇒ nH2 = 0,4 – 0,15 = 0,25 mol
Đáp án C.
Ví dụ 2: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom ; tỉ khối của Y so với H2 bằng 13. Công thức cấu tạo của anken là
A. CH3CH=CHCH3.
B. CH2=CHCH2CH3.
C. CH2=C(CH3)2.
D. CH2=CH2.
Hướng dẫn
Giả sử ban đầu hỗn hợp X có tổng số mol là 1(mol).
Gọi x, y lần lượt là số mol của Hiđro và Anken (CnH2n) → x + y = 1
Vì dX/H2 = 9,1
→ MX = 18,2
→ 2x + 14nyx + y = 18,2
→ 2x + 14ny = 18,2
→ mX = mY = 18,2(g)
dY/H2 = 13 → MY = 26
↔ mY.nY = 26
↔ nY = 0,7
Vì khí Y ko làm mất màu nước Brôm nên Anken phản ứng hết và nY = 0,7
→ nH2 pư = nX – nY = 1 − 0,7 = 0,3 = nCnH2n
→ nH2 bđ = 0,7 (mol)
→ 14n.0,3 + 2.0,7 = 18,2
↔ n = 4
→ CTPT C4H8
Vì anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất nên CTCT của Anken là: CH3−CH=CH−CH3
Đáp án A
Ví dụ 3: Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
A. C2H4.
B. C3H6.
C. C4H8.
D. C5H10.
Hướng dẫn
nH2 = nanken = 1; H = 75%
⇒ nH2 pư = nCnH2n pư = nCnH2n+2 = 0,75
hh A gồm: 0,75 mol CnH2n+2; 0,25 mol H2 dư và 0,25 mol nCnH2n dư
⇒ nA = 1,25 mol
MA = [0.75.(14n + 2) + 0,25.2 + 0,25.14n]/1,25 = 23,2.2 ⇒ n = 4
⇒ C4H8
Đáp án C.