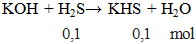KOH + H2S → KHS + H2O - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học KOH + H2Smột cách dễ dàng với đầy đủ điều kiện.
KOH + H2S → KHS + H2O - Cân bằng phương trình hóa học
Phản ứng hóa học:
KOH + H2S → KHS + H2O
Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
Cách thực hiện phản ứng
- Dẫn khí H2S vào ống nghiệm chứa KOH và vài giọt chất chỉ thị.
Hiện tượng nhận biết phản ứng
- Quan sát sự chuyển màu của chỉ thị phù hợp trước và sau phản ứng.
Bạn có biết
- KOH phản ứng với H2S tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối sunfua trung hòa hoặc muối axit hoặc hỗn hợp cả hai muối.
- KOH phản ứng với H2S chỉ thu được muối K2S khi T = 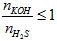

Ví dụ minh họa
Ví dụ 1:
Dẫn từ từ đến dư H2S vào dung dịch KOH thu được dung dịch X. Muối tan có trong dung dịch X là
A. K2S. B. K2S và KHS. C. KHS. D. K2S và KOH.
Hướng dẫn giải
Do H2S dư nên có phản ứng
KOH + H2S → KHS + H2O
Muối tan có trong dung dịch X là KHS.
Đáp án C.
Ví dụ 2:
Cho 2,24 lít khí H2S ở đktc phản ứng với dung dịch chứa 0,1 mol KOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 11 gam. B. 7,2 gam. C. 11,5 gam. D. 10 gam.
Hướng dẫn giải
Có T = 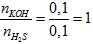
mmuối = 0,1.72 = 7,2 gam.
Đáp án B.
Ví dụ 3:
Dẫn từ từ đến dư H2S vào dung dịch chứa 0,1 mol KOH thu được dung dịch X. Khối lượng muối tan có trong X là
A. 11,0 gam. B. 7,2 gam. C. 13,0 gam. D. 14,4 gam.
Hướng dẫn giải
Do H2S dư nên có phản ứng
mmuối = 0,1.72 = 7,2 gam.
Đáp án B.