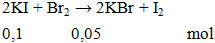2KI + Br2 → 2KBr + I2 - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học KI + Br2 một cách dễ dàng với đầy đủ điều kiện.
2KI + Br2 → 2KBr + I2 - Cân bằng phương trình hóa học
Phản ứng hóa học:
2KI + Br2 → 2KBr + I2
Điều kiện phản ứng
- điều kiện thường.
Cách thực hiện phản ứng
- dẫn khí Br2 vào ống nghiệm chứa KI và vài giọt hồ tinh bột.
Hiện tượng nhận biết phản ứng
- sản phẩm sinh ra làm xanh hồ tinh bột.
Bạn có biết
- Phản ứng này chứng minh tính oxi hóa Brom mạnh hơn iot.

Ví dụ minh họa
Ví dụ 1:
Phản ứng nào chứng minh Brom có tính oxi hóa mạnh hơn iot?
A. Lần lượt cho Brom, iot phản ứng với NaF.
B. Cho Brom, iot phản ứng với nước.
C. cho Brom vào dung dịch KI có sẵn vài giọt hồ tinh bột.
D. Cho NaBr, NaI phản ứng với AgNO3.
Hướng dẫn giải
2KI + Br2 → 2KBr + I2
Đáp án C.
Ví dụ 2:
Cho Brom vào bình đựng KI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng nâu.
B. Dung dịch hiện màu xanh.
C. Dung dịch có màu trắng.
D. Có kết tủa màu vàng nhạt.
Hướng dẫn giải
2KI + Br2 → 2KBr + I2
I2 sinh ra làm xanh hồ tinh bột.
Đáp án B.
Ví dụ 3:
khối lượng brom có trong dung dịch cần dung để phản ứng vừa đủ với 0,1 mol KI là
A. 8g. B. 16g. C. 0,8g. D. 1,6g.
Hướng dẫn giải
m = 0,05.160 = 8g.
Đáp án A.