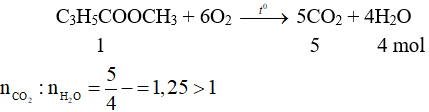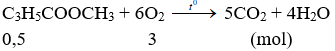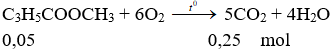Metyl metacrylat + O2 | C3H5COOCH3 + 6O2 → 5CO2 + 4H2O - Cân bằng phương trình hóa học
Có hàng nghìn phản ứng hóa học và để nhớ được các phương trình hóa học đó thật không dễ dàng. Bài học này giúp bạn cân bằng phản ứng hóa học C3H5COOCH3 + O2 một cách dễ dàng với đầy đủ điều kiện.
Metyl metacrylat + O2 | C3H5COOCH3 + 6O2 → 5CO2 + 4H2O - Cân bằng phương trình hóa học
-
Phản ứng hóa học:
C3H5COOCH3 + 6O2
5CO2 + 4H2O
-
Điều kiện phản ứng
- Đốt cháy trong oxi hoặc không khí.
Cách thực hiện phản ứng
- Đốt cháy metyl metacrylat trong không khí, sau phản ứng thu được khí CO2 và hơi nước.
Hiện tượng nhận biết phản ứng
- Phản ứng cháy tỏa nhiều nhiệt, sản phẩm cháy làm đục nước vôi trong.
Bạn có biết
- Các este khác cũng có phản ứng cháy tương tự metyl metacrylat .
- Đốt cháy metyl metacrylat thu được nCO2 > nH2O

-
Ví dụ minh họa
Ví dụ 1: Khi đốt cháy metyl metacrylat thu được CO2 và H2O với tỷ lệ số mol là
A. > 1.
B. < 1.
C. = 1.
D. không xác định được.
Hướng dẫn:
Đáp án A.
Ví dụ 2: Đốt cháy 0,5 mol metyl metacrylat trong không khí cần số mol oxi là
A. 3,25.
B. 2,05.
C. 3,00.
D. 2,25.
Hướng dẫn:
Đáp án C.
Ví dụ 3: Thể tích khí CO2 thu được khi đốt cháy hoàn toàn 0,05 mol metyl metacrylat là?
A. 2,24l.
B. 3,36l.
C. 4,48l.
D. 5,60l.
Hướng dẫn:
V = 0,25.22,4 = 5,6 lít.
Đáp án D.