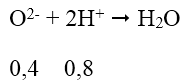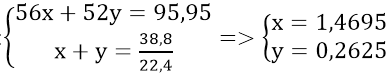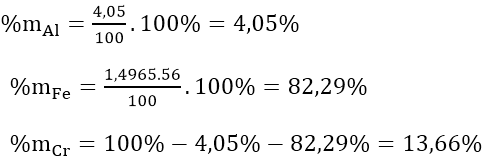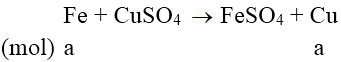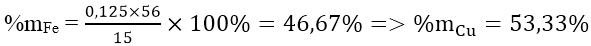Cách giải bài tập Kim loại tác dụng với axit, muối hay, chi tiết
Cách giải bài tập Kim loại tác dụng với axit, muối hay, chi tiết Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải bài tập Kim loại tác dụng với axit, muối hay, chi tiết
Cách giải bài tập Kim loại tác dụng với axit, muối hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Với dung dịch axit
Phản ứng thuộc loại oxi hóa khử nên có thể vận dụng phương pháp bảo toàn electron.
Trong HCl,H2SO4 loãng:Cr và Fe bị H^+ của axit oxi hóa thành Cr2+,Fe2+ còn Cu không phản ứng.
Với H2SO4 đậm đặc,HNO3
+) Cu bị tan ra
+) Fe, Al, Cr bị thụ động trong HNO3 đặc nguội và H2SO4đặc nguội
- Với H2SO4 đặc nóng, HNO3 loãng,HNO3 đặc nóng,… Fe và Cr bị oxi hóa thành
Fe3+,Cr3+
+) S6+ và N5+ nếu bị khử về mức oxi hóa thấp hơn như SO2,NO, NO2,...
Chú ý: Nếu kim loại còn dư, thì thu được muối của sắt II và có thể muối sắt III dư.
Với dd Muối
- Vận dụng ý nghĩa của dãy điện thế cực chuẩn: Cr, Fe, Cu có thể đẩy kim loại yếu hơn ra khỏi muối như Ag, Hg...
- Với dạng bài tập: từ kim loại mạnh, tạo thành kim loại yếu hơn, có sự thay đổi về khối lượng nên vận dụng phương pháp tăng giảm khối lượng.

Ví dụ minh họa
Bài 1: Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
A. 600ml B. 200ml C. 800ml D. 400ml
Hướng dẫn:
Theo ĐL bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) ⇒ nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
VHCl = 0,8 : 2 = 0,4 (lít) = 400ml
Bài 2: Cho 100 gam hợp kim của Fe, Cr, Al tác dụng với một lượng dư dung dịch NaOH thu được 4,98 lít khí. Lấy bã rắn không tan cho tác dụng với một lượng dư dung dịch HCl (không có không khí ) thu được 38,8 lít khí. Các thể tích khí đo ở đktc. Xác định thành phần % của hợp kim.
Hướng dẫn:
Phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
Cr + 2HCl → CrCl2 + H2 (3)
Từ (1)⇒ nAl = 2/3 nH2 = 2/3.4,98/22,4 = 0,15(mol)
⇒ mAl = 0,15.27 = 4,05(gam)
⇒ mCr + Fe = 100 - 4,05 = 95,95(gam)
Gọi số mol Fe và Cr lần lượt là x và y mol
Theo đề bài ta có hệ phương trình:
Vậy:
Bài 3:Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Hướng dẫn:
Phương trình phản ứng:
m tăng = (64 - 56).a = 1 ⇒ a = 0,125 mol
nFe = 0,125 ⇒ nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml B.21,5 ml C. 23,4 ml D. 19,6 ml
Bài 2: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 B. 240 C. 400 D. 120
Bài 3: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít hỗn hợp X gồm(NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối với hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 2,24l B. 5,6l C. 4,48l D. 3,36l
Bài 4: Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch CuSO4 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch HNO3 2M biết phản ứng tạo ra NO.
A. 0,12l B. 0,15 l C. 0,18l D. 0,2l
Bài 5: Cho một hỗn hợp gồm có 1,12 gam Fe và 0,24 gam Mg tác dụng với 250 ml dung dịch CuSO4. Phản ứng thực hiện xong, người ta thu được kim loại có khối lượng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 đã dùng.
A. 0,1M B. 0,12M C. 0,2M D. 0,05M
Bài 6: Hòa tan hoàn toàn hỗn hợp gồm 0,01 mol Al; 0,05 mol Zn và 0,03 mol Fe cần vừa đủ 200ml dung dịch HCl 0,1M và H2SO4 a mol/l. Giá trị của a là?
A. 0,425 B. 0,5 C. 0,625 D. 0,75
Bài 7: Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu đựơc m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (đktc). Giá trị của m1 và m2 lần lượt là:
A. 8,10 và 5,43 B. 1,08 và 5,16
C. 0,54 và 5,16 D. 1,08 và 5,43.
Bài 8: Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g B. 4,4g C. 4,08g D. 5,4g
Bài 9: Hòa tan m gam hỗn hợp A gồm Cu, Ag trong dung dịch HNO3 thu được dung dịch B chứa hỗn hợp 7,06g muối và 0,05 mol NO2 (duy nhất). Giá trị của m là:
A. 2,2 B. 3,06 C. 2,58 D. 3,96
Bài 10: Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
A. 0,1M B. 0,15M C. 0,12M D. 0,2M