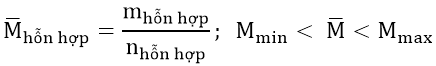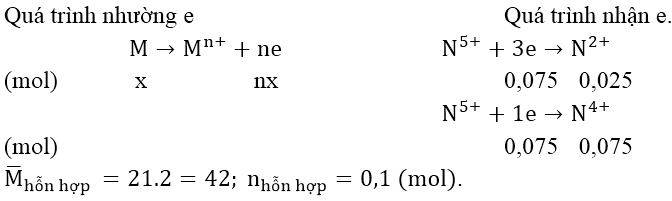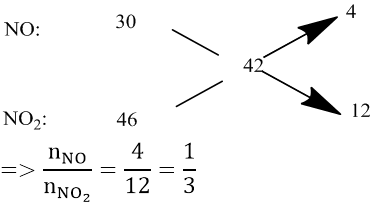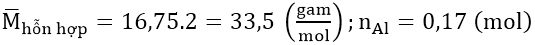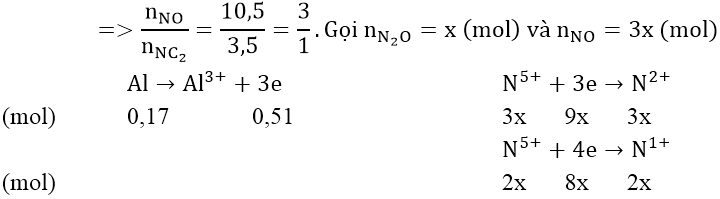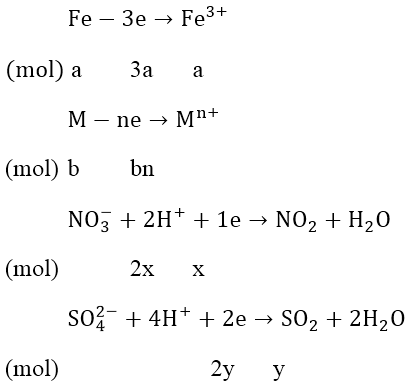7 Phương pháp giải các bài tập về kim loại hay, chi tiết
7 Phương pháp giải các bài tập về kim loại hay, chi tiết Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được 7 Phương pháp giải các bài tập về kim loại hay, chi tiết
7 Phương pháp giải các bài tập về kim loại hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
1. Phương pháp bảo toàn khối lượng:
Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phầm.
Ví dụ. trong phản ứng kim loại tác dụng với axit → muối + H2
Áp dụng bảo toàn khối lượng ta có:
mdung dịch muối = mkim loại + mdung dịch axit - mH2

2. Phương pháp tăng giảm khối lượng:
Dựa vào sự tăng giảm khối lượng khi chuyển từ 1 mol chất A thành 1 hoặc nhiều mol chất B (có thể qua nhiều giai đoạn trung gian) ta có thể tính được số mol của các chất và ngược lại.
Ví dụ. Xét phản ứng: Fe + CuSO4 → FeSO4 + Cu
Ta thấy: cứ 1 mol Fe (56 gam) tan ra thì có 1 mol Cu (64 gam) tạo thành, khối lượng thanh kim loại tăng 64 – 56 = 8 (gam). Như vậy nếu biết được khối lượng kim loại tăng thì có thể tính được số mol Fe phản ứng hoặc số mol CuSO4 phản ứng,...
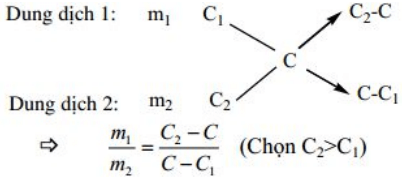
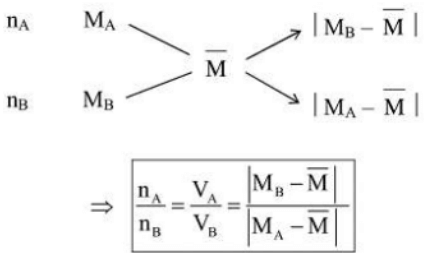
Phương pháp sơ đồ dường chéo:
Thường áp dụng trong các bai tập hỗn hợp 2 chất khí, pha trộn 2 dung dịch, hỗn hợp 2 muối khi biết nồng độ phần trăm của dung dịch (C%) hoặc phân tử khối trung bình (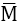
Ví dụ. tính tỉ lệ khối lượng của 2 dung dịch có nồng độ phần trăm tương ứng là C1, C2 cần lấy trộn vào nhau để được dung dịch có nồng độ C%.(C1 < C < C2)
Đối với bài toán có hỗn hợp 2 chất khử, biết phân tử khối trung bình cũng nên áp dụng phương pháp sơ đồ chéo để tính số mol từng khí.
4. Phương pháp nguyên tử khối trung bình:
Trong các bài tập có hai hay nhiều chất có cùng thành phần hóa học, phản ứng tương tự nhau có thể thay chúng bằng một chất có công thức chung, như vậy việc tính toán sẽ rút gọn được số ẩn.
+) Khối lượng phân tử trung bình của một hỗn hợp là khối lượng của 1 mol hỗn hợp đó.
+) Sau khi được giá trị 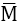
5. Phương pháp bảo toàn electron:
Phương pháp này áp dụng để gải các bài tập có nhiều quá trình oxi hóa khử xảy ra (nhiều phản ứng hoặc phản ứng tạo ra nhiều sản phẩm hoặc phản ứng qua nhiều giai đoạn). Chỉ cần viết các quá trình nhường, nhận electron của các nguyên tố trong các hợp chất. Lập phương trình tổng số mol electron nhường = tổng số mol electron nhận.
6. Phương pháp bảo toàn nguyên tố:
Trong các phản ứng hóa học số mol nguyên tử của các nguyên tố được bảo toàn trước và sau phản ứng.
Ví dụ. xét phản ứng CO + oxit kim loại → kim loại + CO2
Bào toàn nguyên tử O: nCO = nCO2 = nO trong các oxit
7. Phương pháp viết pt phản ứng dưới dạng rút gọn:
Khi giải các bài toán có phản ứng của dung dịch hỗn hợp nhiều chất (dung dịch gồm 2 axit, 2 bazo,...) để tránh viết nhiều phương trình phản ứng, đơn giản tính toán ta viết phương trình ion rút gọn.
Ví dụ minh họa
Bài 1: Hòa tan 1,35 gam một kim loại M bằng dung dịch HNO3 loãng dư thu được 2,24 lít hỗn hợp khí NO và NO2 (đktc) có tỉ khối hơi so với hidro bằng 21. Tìm M.
Hướng dẫn:
Áp dụng phương pháp bảo toàn electron
Áp dụng phương pháp sơ đồ chéo :
⇒ nNO = 0,025(mol) và nNO2 = 0,075 (mol)
Áp dụng định luật bảo toàn số mol electron, ta có:
nX = 0,075 + 0,075 = 0,15 và MX = 1,35 ⇒ M = 9n
+) Khi n = 1 ⇒ M = 9 (loại)
+) Khi n = 2 ⇒ M = 18 (loại)
+) Khi n = 3 ⇒ M = 27 (kim loại là Al)
Bài 2: Hòa tan 4,59 gam nhôm trong dung dịch HNO3 1M thu được hỗn hợp X gồm hai khí NO và NO2, tỉ khối hơi của X đối với hidro bằng 16,75. Tính :
a) Thể tích mỗi khí đo ở đktc.
b) Khối lượng muối thu đươc.
c) Thể tích dung dịch HNO3 đã dùng.
Hướng dẫn:
Ta có:
Áp dụng phương pháp sơ đồ chéo:
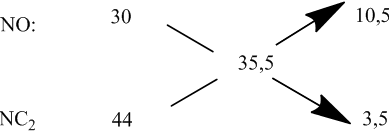
Áp dụng bảo toàn số mol electron: 17x = 0,51 ⇒ x = 0,03 (mol)
⇒ nNO = 0,09 (mol); nN2O = 0,03 (mol)
VNO = 0,09.22,4 = 2,016 (lít); VH2O = 0,03.22,4 = 0,672 (lit)
nHNO3 = nHNO3 bị khử + nHNO3 tham gia tạo muối = 5x + 3.nAl = 0,03 + 3.0,17 = 0,66(mol)
mmuối = nAl.M = 0,17.213 = 36,21 (gam)
VHNO3 đã dùng = 0,66/1 = 0,66 (lít)
Bài 3:
a) Hòa tan m gam hỗn hợp A gồm Fe và kim loại M (M có hóa trị không đổi) trong dung dịch HCl dư thì thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối khan. Tính m.
b) Hòa tan hết cùng lượng hỗn hợp A (ở phần 1) trong dung dịch chứa hỗn hợp HNO3 và H2SO4 ở nhiệt độ thích hợp thì thu được 1,8816 lít hỗn hợp 2 khí (đktc) có tỉ khối so với H2 là 25,25. Xác định tên kim loại M.
Hướng dẫn:
mmuối = mFeCl2 + mMCln
⇔ (56 + 71)a + (M + 35,5)b = 4,575 ⇔ m = 1,38
Áp dụng định luật bảo toàn điện tích:
3a + nb = x + 2y = 0,105
Từ (1) và (2) ⇒ a = 0,015 (mol) và nb = 0,06
Mặt khác: 56a + Mb = 1,38 ⇒ Mb = 0,54
M = 9n ⇒ Nghiệm thích hợp n = 3, M = 27 (Al)
B. Bài tập trắc nghiệm
Bài 1: Oxi hóa hoàn toàn 0,792 gam hỗn hợp bột Fe và Cu ta thu được 1,032 gam hỗn hợp các oxit (hỗn hợp X). hãy tính thể tích khí H2 (đktc) tối thiểu cần để khử hoàn toàn các oxit thành kim loại.
A. 0,336 l B. 0,224 l C. 0,15l C. 0,448l
Bài 2: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
A. 1M B. 0,5M C. 0,25M D. 0,4M
Bài 3: Oxi hóa hoàn toàn 0,792 gam hỗn hợp bột Fe và Cu ta thu được 1,032 gam hỗn hợp các oxit (hỗn hợp X). Hãy tính thể tích khí H2 (đktc) tối thiểu cần để khử hoàn toàn các oxit thành kim loại.
A. 1,12l B. 0,48l C. 0,336l D. 0,24l
Bài 4: Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đều nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.
A. 14,336l B. 11,2l C. 20,16l C. 14,72l
Bài 5: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vủa đủ dung dịch H2SO4 10% thu được 2,24 lít khí H2 (đktc). Khối lượng dung dịch thu được sau phản ứng là:
A. 101,48 gam B. 101,68 gam
C. 97,80 gam D. 88,20 gam
Bài 6: Hòa tan hết 7,74 g hỗn hợp bột M, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít H2 (ở đktc). Cô cạn dung dịch X thu được lượng muối khan là:
A. 38,93 gam B. 103,85 gam C. 25,95 gam D. 77,86 gam.
Bài 7: Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7:3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là:
A. 448 B. 40,5 C. 33,6 D. 50,4
Bài 8: Một dung dịch có chứa các ion: x mol M3+, 0,2 mol Mg2+, 0,3 mol Cu2+, 0,6 mol SO42-, 0,4 mol NO3-. Cô cạn dung dịch này thu được 116,8 gam hỗn hợp các muối khan. M là:
A. Cr B. Fe. C. Al D. Zn