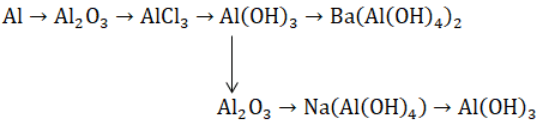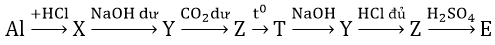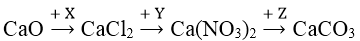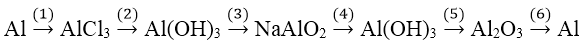Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm cực hay
Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm cực hay Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm cực hay
Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm cực hay
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Để làm tốt dạng bài tập này cần nằm vững tính chất hóa học của đơn chất, hợp chất của kim loại kiềm, kiềm thổ, nhôm và sự chuyển hóa giữa chúng. Đặc biệt lưu ý đến các tính chất đặc biệt như tính lưỡng tính của nhôm, trình tự phản ứng của các chất. Cần xác định loại phản ứng, có sự thay đổi số oxi hóa hay không để lựa chọn chất cần phản ứng cho thích hợp.

Ví dụ minh họa
Bài 1: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
Hướng dẫn:
(1) 4Al + 3O2 → 2AlCl3 + 3H2
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
(4) 2Al(OH)3 + Ba(OH)2 → Ba(Al(OH)4)2
(5) 2Al(OH)3 −tº→ Al2O3 + 3H2O
(6) Al2O3 + 2NaOH + 3H2O → 2Na(Al(OH)4)
(7) Na(Al(OH)4) + CO2 → NaHCO3 + Al(OH)3
Bài 2: Chọn X, Y, Z, T, E- theo đúng trật tự tương ứng trong sơ đồ sau:
Hãy viết các phản ứng theo sơ đồ trên.
Hướng dẫn:
Phản ứng
2Al + 6HCl → 2AlCl3 + 3H_2
AlCl3 + 4NaOH → NaAlO2+ 3NaCl + 2H2O
NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
2Al(OH)3 −tº→ Al2O3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
H2O + NaAlO2 + HCl → Al(OH)3 + NaCl
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Bài 3: Ion Na+ có tồn tại hay không, nếu ta thực hiện các phản ứng hóa học sau:
a. NaOH tác dụng với dung dịch HCl.
b. NaOH tác dụng với dung dịch CuCl2.
c. Phân hủy NaHCO3 bằng nhiệt.
d. Điện phân NaOH nóng chảy.
e. Điện phân NaCl nóng chảy.
Hướng dẫn:
a. Có, vì: NaOH + HCl → NaCl + H2O
b. Có, vì: 2NaOH + CuCl2 → 2NaCl + Cu(OH)2
c. Có, vì: 2NaHCO3 −tº→ Na2CO3 + H2O + CO2↑
d. Không, vì: 4NaOH → 4Na + 2H2O + O2↑
e. Không, vì: 2NaCl → 2Na + 2Cl2↑
B. Bài tập trắc nghiệm
Bài 1: Phản ứng vừa tạo kết tủa vừa có khi bay ra là:
A. FeSO4 + HNO3
B. KOH + Ca(HCO3)2
C. MgS + H2O
D. BaO + NaHSO4
Bài 2: Cho sơ đồ chuyển hóa sau:
Công thức của X, Y, Z lần lượt là:
A. Cl2, AgNO3, MgCO3.
B. Cl2, HNO3, CO2.
C. HCl, HNO3, NaNO3.
D. HCl, AgNO3, (NH4)2CO3.
Bài 3: Hòa tan hỗn hợp gồm: K2O, BaO, Al2O3, Fe3O4 vào nước (dư) thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là:
A. K2CO3 B. Fe(OH)3 C. Al(OH)3 D. BaCO3
Bài 4: Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển đổi sau:
Bài 5: Tùy thuộc nồng độ của dung dịch HNO3, kim loại nhôm có thể khử HNO3 thành NO2, NO, N2 hoặc NH4NO3. Hãy viết phương trình hóa học của những phản ứng trên.
Bài 6: Phản ứng nào sau đây không xảy ra:
A. CaO + CO2 → CaCO3
B. Ca(OH)2 + CO2 → CaCO3 + H2O
C. CaCl2 + MgCO3 → CaCO3 + MgCl2
D. CaO + H2O → Ca(OH)2
Bài 7: Nung nóng từng cặp chất sau trong bình kín:
(1) H2(k) + CuO(r) ; (2) C (r) + KClO3; (3) Fe (r) + O2(r)
(4) Mg(r) + SO2(k); (5) Cl2(k) + O2(k); (6) K2O (r) + CO2(k)
Số trường hợp có phản ứng hóa học xảy ra là:
A. 4 B. 2 C. 3 D. 5
Bài 8: Viết phương trình phản ứng để giải thích hiện tượng xảy ra khi:
a. Cho dd NH3 dư vào dd AlCl3.
b. Cho từ từ dd NaOH đến dư vào dd AlCl3.
c. Cho từ dd Al2(SO4)3 vào dd NaOH và ngược lại.