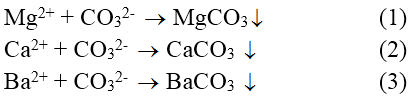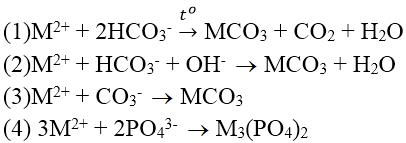Cách giải các dạng bài tập về nước cứng hay, chi tiết
Cách giải các dạng bài tập về nước cứng hay, chi tiết Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải các dạng bài tập về nước cứng hay, chi tiết
Cách giải các dạng bài tập về nước cứng hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
* Lưu ý:
- Nước có nhiều ion Ca2+, Mg2+ là nước cứng.
- Nước không chứa hoặc chứa ít các ion trên gọi là nước mềm.
+ Nước cứng tạm thời: chứa các ion: Ca2+, Mg2+, HCO-3.
+ Nước cứng tạm thời: chứa các ion: Ca2+, Mg2+, Cl- ,SO2-4.
Cách làm mềm nước:
Phương pháp hóa học:
Đối với nước cứng tạm thời, đun nóng hoặc dùng Ca(OH)2 rồi lọc kết tủa
Ca(HCO3)2 −tº→ CaCO3 + CO2↑ + H2O
Mg(HCO3)2 + Ca(OH)2 → Mg(OH)2↓ + 2CaCO3 + H2O
Cả 2 loại nước cứng đều có thể dùng dung dịch Na2CO3
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3

Ví dụ minh họa
Bài 1: Trong thể tích nước cứng có chứa 6.10-5 mol CaSO4 cần số gam Na2CO3 đủ làm mềm thể tích nước đó là:
A. 7,20 mg
B. 6,82 mg
C. 7,00 mg
D. 6,36 mg
Hướng dẫn:
Phản ứng: Na2CO3 + CaSO4 → CaCO3 + Na2SO4
Số mol Na2SO4 = số mol CaSO4 = 6.10-5 (mol)
Khối lượng Na2CO3 cần dùng là:
106 . 6.10-5 gam = 636.10-5 (gam) = 6,36 (mg)
Bài 2: Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), HCO3- (0,10 mol) và SO42- (0,01 mol). Đun sôi cốc nước trên cho đến khi phản ứng xảy ra hoàn toàn thì nước trong cốc:
A. có tính cứng toàn phần B. có tính cứng vĩnh cửu
C. là nước mềm D. có tính cứng tạm thời.
Hướng dẫn:
- Phản ứng khi đun sôi:
- Nhận xét: 2. nCa2+ + Mg2+ = 2.(0,02 + 0,04) = 0,12 > nHCO3-
Nên sau khi đun nóng HCO3- đã chuyển hết thành kết tủa và CO2. Trong dung dịch còn Cl-,SO42- (Mg2+, Ca2+) dư nên nước còn lại trong cốc có tính cứng vĩnh cửu.
Bài 3: Dung dịch A chứa các cation Mg2+, Ca2+, Ba2+ và 0,1 mol Cl-, 0,2 mol NO3-. Thêm V lít dung dịch K2CO3 1M vào dung dịch A để thu được lượng kết tủa lớn nhất. Giá trị của V là:
A. 150 ml
B. 300 ml
C. 200 ml
D. 250 ml
Hướng dẫn:
Các phương trình ion rút gọn:
Gọi x, y và z là số mol Mg2+, Ca2+ và Ba2+ trong dung dịch A. Dung dịch trung hòa điện nên: 2x + 2y + 2z = 0,1 + 0,2 = 0,3 → x + y + z = 0,15
Từ (1), (2) và (3) ⇒ nCO32- = x + y + z = 0,15 = nK2CO3
⇒ Vdd K2CO3 = 0,15/1 = 0,15 (lit)=150 (ml)
Bài 4: Phát biểu nào sau đây là đúng?
A. Nước cứng là nước có chứa các muối CaCl2, MgCl2,...
B. Nước mềm là nước có chứa ít hoặc không chứa các ion Ca2+, Mg2+
C. Nước trong tự nhiên đều là nước cứng vì có chứa cation Ca2+, Mg2+.
D. Nước khoáng đều là nước cứng.
Hướng dẫn:
Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+.
Nếu nước có chứa Ca2+, Mg2+ nhưng dưới mức tới hạn thì không gọi là nước cứng.
B. Bài tập trắc nghiệm
Bài 1: Cho 2 cốc nước chứa các ion: Cốc 1: Ca2+, Mg2+, HCO3-, Cốc 2: Ca2+, HCO3-, Cl-, Mg2+. Để khử hoàn toàn tính cứng của nước ở cả hai cốc người ta:
A. Cho vào 2 cốc dung dịch NaOH dư
B. Đun sôi một hồi lâu 2 cốc
C. Cho vào 2 cốc một lượng dư dung dịch Na2CO3
D. Cho vào 2 cốc dung dịch NaHSO4
Bài 2: Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl-(0,02 mol), HCO3- (0,10 mol) và SO42-(0,01 mol). Đun sối cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc:
A. Có tính cứng hoàn toàn
B. Có tính cứng vĩnh cửu
C. Là nước mềm
D. Có tính cứng tạm thời
Bài 3: Trong một cốc nước có chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Nước trong cốc là:
A. Nước mềm
B. Nước cứng tạm thời
C. Nước cứng vĩnh cửu
D. Nước cứng toàn phần
Bài 4: Cho các phản ứng mô tả các phương pháp khác nhau để làm mềm nước cứng (dùng M2+ thay cho Ca2+ và Mg2+) như sau:
Phương pháp nào có thể áp dụng với nước có tính cứng tạm thời?
A. (1)
B. (2)
C. (1) và (2)
D. (1), (2), (3) và (4)
Bài 5: Có các chất sau:
(1) NaCl (2) Ca(OH)2 (3) Na2CO3
(4) HCl (5) K3PO4
Các chất có thể làm mềm nước cứng tạm thời là:
A. 1, 3, 5
B. 2, 3, 4
C. 2, 3, 5
D. 3, 4, 5
Bài 6: Có các chất sau : NaCl, Ca(OH)2 ,Na2CO3, HCl . Cặp chất nào có thể làm mềm nước cứng tạm thời :
A. NaCl và Ca(OH)2
B. Ca(OH)2 và Na2CO3
C. Na2CO3 và HCl
D. NaCl và HCl
Bài 7: Ðể làm mềm nước cứng vĩnh cửu ta có thể dùng:
A. HCl
B. K2CO3
C. CaCO3
D. NaCl
Bài 8: Nước cứng tạm thời là nước cứng có chứa ion HCO3- . Nước cứng vĩnh cửu là nước cứng có chứa ion Cl- hay SO42-. Để làm mềm nước cứng có 3 loại ion trên người ta:
A. Đun sôi nước
B. Dùng lượng vừa đủ Ca(OH)2
C. Dùng dung dịch Na2CO3
D. Các câu trên đều đúng.
Bài 9: Phát biểu nào sai khi nói về nước cứng:
A. Nước cứng là nước có nhiều ion Ca2+ và Mg2+
B. Nước cứng tạm thời là nước cứng có chứa ion HCO3-
C. Nước cứng vĩnh cữu là nước cứng có chứa ion CO32- và Cl-
D. Nước mềm là nước có chứa ít ion Ca2+ và Mg2+
Bài 10: Một mẫu nước cứng chứa các ion : Ca2+, Mg2+, HCO3-, Cl- , SO42- . Chất được dùng để làm mềm nước cứng trên là :
A. Na2CO3
B. HCl
C. H2SO4
D. NaHCO3
Bài 11: Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là :
A. NaOH, Na3PO4 , Na2CO3
B. HCl, NaOH , Na2CO3
C. KCl, Ca(OH)2, Na2CO3.
D. HCl, Ca(OH)2, Na2CO3.
Bài 12: Chất nào sau đây được dùng để làm mềm nước cứng vĩnh cửu?
A. Na2CO3 và Na3PO4 B. Na2SO4 và Na3PO4.
C. HCl và Na2CO3. D. HCl và Ca(OH)2.