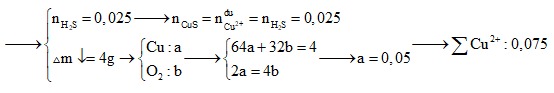Bài tập điện phân cơ bản có lời giải
Bài tập điện phân cơ bản có lời giải Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Bài tập điện phân cơ bản có lời giải
Bài tập điện phân cơ bản có lời giải
A. Định hướng tư duy
Bài toán điện phân thực chất cũng giống như những quá trình oxi hóa khử mà chúng ta vẫn xét. Tuy nhiên, sự khác biệt ở đây là có sự tham gia của dòng điện một chiều. Dưới đây tôi xin giới thiệu kỹ thuật giải toán về điện phân dung dịch. Để làm tốt dạng toán này các bạn cần chú ý một số vấn đề sau:
Tại cực (-) catôt
Các ion dương bị hút về phía catôt.
Thứ tự điện phân là: 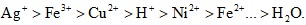
Các ion của kim loại từ Al3+ về trước 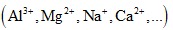 không bị điện phân.
không bị điện phân.
Phương trình điện phân 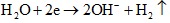
Tại cực (+) anôt
Các ion âm bị hút về phía anôt.
Thứ tự điện phân là: 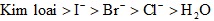
Các ion 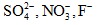 không bị điện phân trong dung dịch.
không bị điện phân trong dung dịch.
Phương trình điện phân H2O: 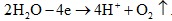
Chú ý : Nếu anôt làm bằng kim loại (Cu) thì anôt sẽ bị tan (bị điện phân) đầu tiên

Khi giải toán chúng ta sẽ tư duy chặn đầu bằng cách hỏi xem:
+ Dung dịch sau điện phân còn gì ?
+ Ở hai cực xảy ra những phản ứng gì?
+ Khối lượng thay đổi là do đâu ?
+ Số mol ne có tính ngay được theo công thức 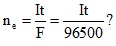
+ Cần chú ý sau điện phân có 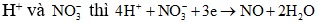
+ Cần hết sức cẩn thận với những bài toán có sự di chuyển ion giữa các cực.
+ Cuối cùng là áp dụng các định luật bảo toàn .
B. Ví dụ minh họa
Câu 1: Điện phân 200 ml dung dịch CuSO4 với điện cực trơ bằng dòng điện một chiều I = 9,65 A. Khi thể tích khí thoát ra ở cả hai điện cực đều là 1,12 lít (đktc) thì dừng điện phân. Khối lượng kim loại sinh ra ở catot và thời gian điện phân là:
A. 3,2 gam và 2000 giây. B. 2,2 gam và 800 giây.
C. 6,4 gam và 3600 giây. D. 5,4 gam và 800 giây.
Định hướng tư duy giải:
Để có khí thoát ra ở cả hai điện cực thì bên catot phải xảy ra quá trình điện phân H2O. Cần nhớ là số mol e ở hai điện cực luôn bằng nhau.
Số mol khí 2 cực là : nH2 = n O2 = 1,12:22,4 =0,05 mol
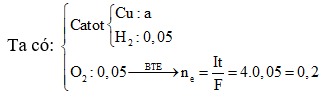
Vì số mol electron trao đổi ở 2 cực như nhau nên BT electron :
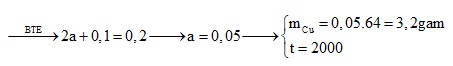
Câu 2: Điện phân 200 ml dung dịch X chứa FeCl3 0,1M và CuSO4 0,15M với dòng điện một chiều cường độ dòng điện I = 2A trong 4825 giây (điện cực trơ, hiệu suất 100%) thu được dung dịch Y có khối lượng ít hơn X là m gam. Giá trị của m là?
A. 4,39 B. 4,93 C. 2,47 D. Đáp án khác.
Định hướng tư duy giải:

Câu 3: Điện phân Al2O3 nóng chảy, dư với dòng điện có I = 19,3A; thời gian là 20 giờ. Khối lượng nhôm thu được là:
A. 129,6 g B. 162,0 g C. 324,0 g D. 108,0 g
Định hướng tư duy giải:
Ta có:
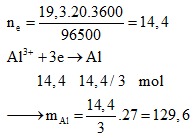
C. BÀI TẬP VẬN DỤNG
Câu 1: Điện phân dung dịch CuCl2 với điện cực trơ, sau một thời gian thu được 0,32 gam Cu ở catot và một lượng khí X ở anot. Hấp thụ hoàn toàn lượng khí X vào 200ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,05 M (giả thiết thể tích dung dịch không thay đổi). Nồng độ ban đầu của dung dịch NaOH là:
A. 0,15M B. 0,2M
C. 0,1M D. 0,05M
Câu 2: Điện phân 400ml dung dịch hỗn hợp CuSO4 1M và NaCl 1M một thời gian đến khi ở catôt thu được 4,48 lít khí thì dùng điện phân. Thể tích khí thu được ở anôt là (các khi cùng đo ở đktc):
A. 11,2 lít. B. 8,96 lít.
C. 6,72 lít. D. 5,6 lít.
Định hướng tư duy giải
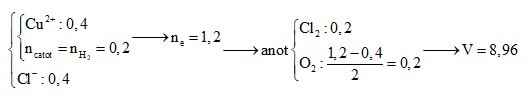
Câu 3: Điện phân 200 ml dung dịch CuSO4 với điện cực trơ bằng dòng điện một chiều I = 9,65 A. Khi thể tích khí thoát ra ở cả hai điện cực đều là 1,12 lít (đktc) thì dừng điện phân. Khối lượng kim loại sinh ra ở catot và thời gian điện phân là:
A. 3,2 gam và 2000 giây. B. 2,2 gam và 800 giây.
C. 6,4 gam và 3600 giây. D. 5,4 gam và 800 giây.
Định hướng tư duy giải
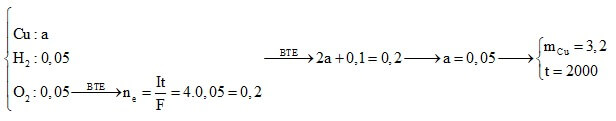
Câu 4: Điện phân (với điện cực trơ) 200 ml dung dịch CuSO4 nồng độ x mol/l, sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 8 gam so với dung dịch ban đầu. Cho 16,8 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,4 gam kim loại. Giá trị của x là
A. 2,25. B. 1,5.
C. 1,25. D. 3,25.
Định hướng tư duy giải
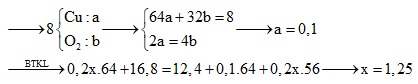
Câu 5: Điện phân 200 ml dung dịch X chứa Cu(NO3)2 và AgNO3 với cường độ dòng điện 0,804A đến khi bọt khí bắt đầu thoát ra ở catot thì mất 2 giờ, khi đó khối lượng catot tăng thêm 4,2 gam. Nồng độ mol của Cu(NO3)2 trong dung dịch X là
A. 0,1M. B. 0,075M.
C. 0,05M. D. 0,15M
Định hướng tư duy giải
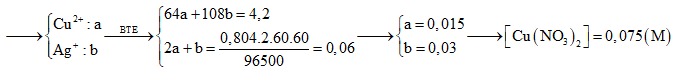
Câu 6: Điện phân với điện cực trơ 500ml dung dịch CuSO2 aM đến khi thu được 1,12 lít khí (đktc) ở anốt thì dừng lại. Ngâm một lá sắt dư vào dung dịch sau điện phân đến khi phản ứng hoàn toàn thì thấy khối lượng lá sắt tăng 0,8 g. Tính a dung dịch CuSO4 ban đầu :
A. 0,2M B. 0,4M
C. 1,9M D. 1,8M
Định hướng tư duy giải
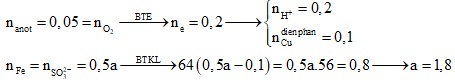
Câu 7: Tiến hành điện phân (với điện cực trơ, hiệu suất là 100%) dung dịch X chứa 0,02 mol CuCl2; 0,02 mol CuSO4 và 0,005 mol H2SO4 trong thời gian 32 phút 10 giây với cường độ dòng điện không đổi là 2,5 ampe thì thu được 200 ml dung dịch Y. Giá trị pH của dung dịch Y là
A. 1,78. B. 1,00.
C. 0,70. D. 1,08.
Định hướng tư duy giải
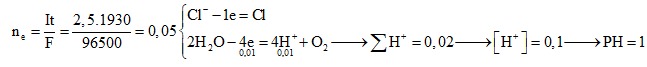
Câu 8: Tiến hành điện phân 200 ml dung dịch X gồm HCl 0,60M và CuSO4 1M với điện cực trơ, cường độ dòng điện một chiều không đổi bằng 1,34A, trong 4 giờ. Số gam kim loại bám vào catot và số lít khí (ở đktc) thoát ra ở anot là
A. 3,20 và 0,896. B. 6,40 và 0,896.
C. 6,40 và 1,792. D. 3,20 và 1,792.
Định hướng tư duy giải
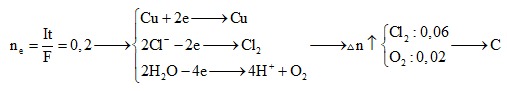
Câu 9: Điện phân 200 ml dung dịch hỗn hợp AgNO3 0,1 M và Cu(NO3)2 0,2 M với điện cực trơ và cường độ dòng điện bằng 5A. Sau 19 phút 18 giây dùng điện phân, lấy catot sấy khô thấy tăng m gam. Giá trị của m là:
A. 5,16 gam B. 1,72 gam
C. 2,58 gam D. 3,44 gam
Định hướng tư duy giải
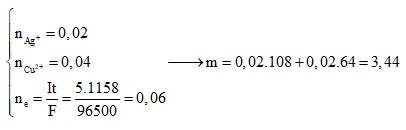
Câu 10: Sau một thời gian điện phân 100ml dung dịch CuSO4 với điện cực trơ, khối lượng dung dịch giảm 4 gam. Để làm kết tủa hết ion Cu2+ còn lại trong dung dịch sau khi điện phân cần dùng 50 ml dung dịch H2S 0,5M. Nồng độ mol/l của dung dịch CuSO4 trước lúc điện phân là
A. 0,375M. B. 0,420M.
C. 0,735M. D. 0,750M.
Định hướng tư duy giải