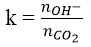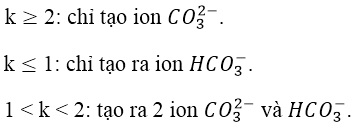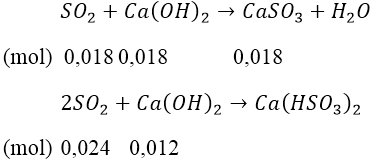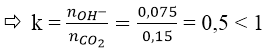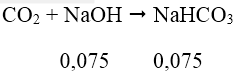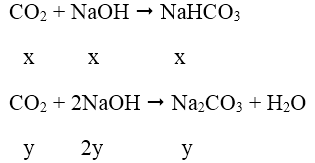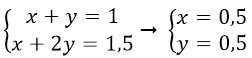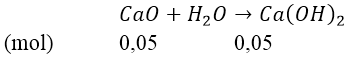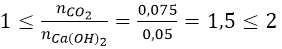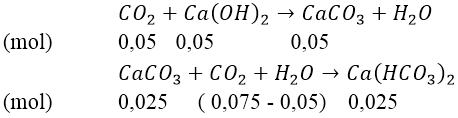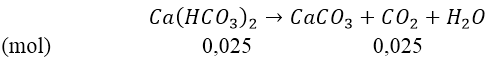Cách giải bài tập CO2, SO2 tác dụng với dung dịch kiềm hay, chi tiết
Cách giải bài tập CO2, SO2 tác dụng với dung dịch kiềm hay, chi tiết Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải bài tập CO2, SO2 tác dụng với dung dịch kiềm hay, chi tiết
Cách giải bài tập CO2, SO2 tác dụng với dung dịch kiềm hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Tác dụng với NaOH, KOH, Ca(OH)2, Ba(OH)2
Đối với bài toán này ta tính hệ số k:
Nếu:
PTHH tạo muối:
Lưu ý:
- Hấp thụ CO2 vào NaOH dư/ nước vôi dư chỉ tạo muối Na2CO3/ CaCO3.
- Hấp thụ CO2 dư vào NaOH/ nước vôi chỉ tạo muối NaHCO3/ Ca(HCO3)2.
- Hấp thụ CO2 vào NaOH tạo dung dịch muối. Sau đó thêm BaCl2 vào dung dịch muối thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa: tạo ra 2 muối Na2CO3 và NaHCO3.
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa. Sau đó thêm NaOH dư vào thấy có kết tủa nữa: tạo ra 2 muối CaCO3 và Ca(HCO3)2.
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa, lọc bỏ kết tủa rồi đun nung nóng lọc lại thấy kết tủa trắng nữa: tạo ra 2 muối CaCO3 và Ca(HCO3)2.
- Nếu bài toán không cho bất kì dữ liệu nào thì phải cho trường hợp để giải.

Ví dụ minh họa
Bài 1: Cho V lít SO2 (đktc) vào 300 ml dung dịch Ca(OH)2 0,1M thu được 2,08 gam kết tủa. Tìm V.
Hướng dẫn:
Ta có: nCa(OH)2= 0,1 × 0,3 = 0,03 (mol)
Kết tủa là CaSO3 ⇒ nCaSO3 = 2,6/120 = 0018 (mol)
+) Trường hợp 1: Ca(OH)2 dư:
nSO2 = 0,018 (mol) ⇒ V = 0,4032 (lít)
+) Trường hợp 2: xảy ra xả 2 phản ứng.
nSO2 = 0,018 + 0,024 = 0,042 (mol) ⇒ V = 0,9408 (lít)
Bài 2: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 5,8 g B. 6,5 g C. 4,2 g D. 6,3 g
Hướng dẫn:
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 −tº→ RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
⇒ tạo ra muối NaHCO3 và CO2 dư.
⇒ mmuối = 0,075.84 = 6,3(g)
Bài 3: Cho 100g CaCO3 tác dụng hoàn toàn với dung dịch HCl để lấy khí CO2 sục vào dung dịch chứa 60 g NaOH. Tính khối lượng muối natri thu được.
Hướng dẫn:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Số mol CaCO3 nCaCO3 = 100/100 = 1 mol
Số mol CO2 nCO2 = nCaCO3 = 1 mol
Số mol NaOH nNaOH = 60/40 = 1,5 mol
Lập tỉ lệ k = nNaOH/nCO2 = 1,5/1 = 1,5
k = 1,5 phản ứng tạo ra hai muối NaHCO3 và Na2CO3
Gọi x, y lần lượt là số mol NaHCO3 và Na2CO3.
Theo bài ra ta có hệ
Khối lượng NaHCO3 m = 84.0,5 = 42(g)
Khối lượng Na2CO3 m = 106.0,5 = 53 (g)
Bài 4: Cho 2,8 gam CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2 (đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Hướng dẫn:
Ta có: nCaO = 2,8/56 = 0,05(mol) và nCO2 = 1,68/22,4 = 0,075(mol)
Phản ứng:
Lập tỉ lệ:
Như vậy, sau phản ứng tạo thành 2 muối:
⇒ mCaCO3 = 100(0,05 - 0,025) = 2,5(gam)
Khi đun nóng dung dịch:
Vậy khi đun nóng, khối lượng kết tủa thu được tối đa là 5 gam.
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là:
A. 23,2 B. 12,6 C. 18,0 D. 24,0
Bài 2: Sục V lít CO2 (đktc) vào 150 ml dung dịch Ba(OH)2 1M sau phản ứng thu được 19,7 gam kết tủa. Tính V?
A. 2,24l B. 3,36l C. 4,48l D. Cả A và C
Bài 3: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là:
A. 0,4M B. 0,2M C. 0,6M D. 0,1M
Bài 4: Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 có nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là:
A. 0,032 B. 0,048 C. 0,06 D. 0,04
Bài 5: Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào m gam dung dịch hỗn hợp chứa 0,05 mol NaOH; 0,05mol KOH; 0,05 mol Ba(OH)2. Dung dịch sau phản ứng có khối lượng?
A. (m – 11,65) gam
B. (m + 6,6) gam
C. (m – 5,05) gam
D. (m – 3,25) gam
Bài 6: Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00
B. 0,75
C. 1,25
D. 1,00
Bài 7: Hấp thụ hoàn toàn 4,48 lít CO2 ở (đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là:
A. 19,70 B. 17,73 C. 9,85 D. 11,82
Bài 8: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Giá trị của X là:
A. 1,0 B. 1,4 C. 1,2 D. 1,6