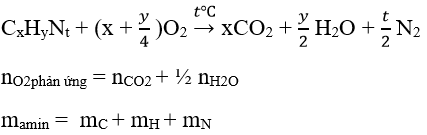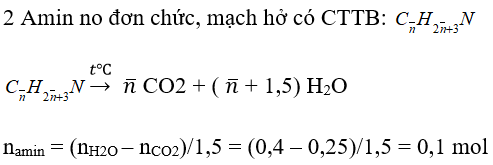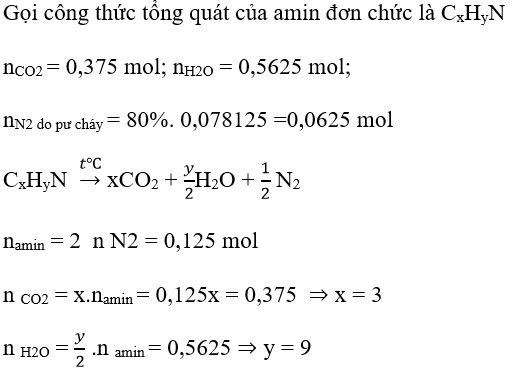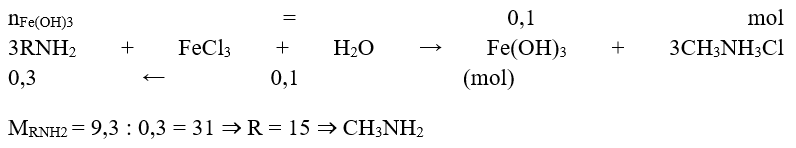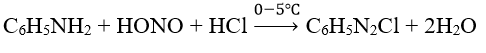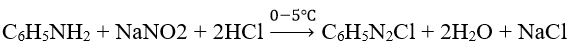7 dạng bài tập về Amin trong đề thi Đại học có giải chi tiết - Hoá 12
7 dạng bài tập về Amin trong đề thi Đại học có giải chi tiết Hóa học lớp 12 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được 7 dạng bài tập về Amin trong đề thi Đại học có giải chi tiết
7 dạng bài tập về Amin trong đề thi Đại học có giải chi tiết - Hoá 12
- Amin bậc 1: NH2R
- Amin bậc 2: NHR2
- Amin bậc 3: NR3
Dạng 1: Xác định số đồng phân, gọi tên amin
Phương pháp :
- Xác định độ bất bão hòa của phân tử (số liên kết , số vòng); với hợp chất CxHyNzOt theo biểu thức : δ = (2x + 2 + z - y)/2
- Xác định các loại mạch cacbon: Mạch không nhánh, mạch có nhánh, vòng...
- Các loại nhóm chức, vị trí nhóm chức...
- Tên gọi theo tên thông tường, tên gốc chức, tên thay thế.
Ví dụ 1 : Ứng với công thức phân tử C4H11N có bao nhiêu công thức cấu tạo của amin:
A. 8 B.7 C.6 D.5
Hướng dẫn giải :
δ = (2.4+2+1-11)/2 = 0
⇒ Amin no, mạch hở
Amin bậc 1:
CH3 – CH2 – CH2 – CH2 – NH2
CH3 – CH2 – CH(NH2) – CH3
CH3 – CH(CH3) – CH2 – NH2
(CH3)2 – C(NH2) – CH3
Amin bậc 2:
CH3 – CH2 – CH2 – NH – CH3
(CH3)2 – CH – NH – CH3
CH3 – CH2 – NH – CH2 – CH3
Amin bậc 3:
CH3 – CH2 – N – (CH3)2
⇒ 8 công thức
→ Đáp án A
Ví dụ 2 : Amin (CH3)2CHCH2 – NH2 có tên gọi là:
A. 2-metylpropan – 1 – amin
B. 2-metylpropan – 3 – amin
C. Metylpropylamin
D. 2 – Metylpropyl – 1 – amin
→ Đáp án A

Dạng 2: So sánh tính bazơ
Phương pháp :
Tính bazơ của amin phụ thuộc vào đặc điểm của gốc R liên kết với N của nhóm amin
- Nếu R có tác dụng đẩy e ⇒ tính bazơ amin càng mạnh ( mạnh hơn NH3)
- Nếu R có tác dụng hút e ⇒ tính bazơ yếu
(Rthơm)3N <(Rthơm)2NH < RthơmNH2 < NH3 < RnoNH2 < (Rno)2NH < (Rno)3N
Ví dụ 1 : Cho các chất sau:
(1). Amoniac
(2). Anilin
(3). p – Nitroanilin
(4). p – Metyanilin
(5). Metylamin
(6). Đimetylamin
Tính bazơ tăng dần của cac chất được sắp xếp theo dãy nào sau đây?
A. (3) < (2)< (4) < (1) < (5) < (6)
B. (3) < (4) < (2) < (1) < (5) < (6)
C. (6) < (5) < (1) < (4) < (2) < (3)
D. (5) < (4) < (2) < (1) < (3) < (6)
Hướng dẫn giải :
- Vòng benzen hút electron mạnh hơn nguyên tử H nên các amin thơm có tính bazơ yếu hơn NH3
- Gốc metyl –CH3 đẩy e mạnh hơn nguyên tử H nên các amoin có nhóm –CH3 có tính bazơ mạnh hơn NH3; và đimetyl amin có tính bazơ mạnh hơn metylamin ⇒ (1) < (5) < (6)
- Trong các amin thơm, nhóm -NO2 có liên kết đôi là nhóm hút e nên làm giảm lực bazơ, nhóm metyl –CH3 là nhóm đẩy e nên làm tăng lực bazơ (3) < (2)< (4) < (1)
→ Đáp án A
Ví dụ 2 : Cho các chất: (1) amoniac; (2) metylamin; (3) anilin; (4) dimetylamin. Tính bazơ tăng dần theo thứ tự nào sau đây?
A. (1) < (3) < (2) < (4).
B. (3) < (1) < (2) < (4).
C. (1) < (2) < (3) < (4).
D. (3) < (1) < (4) < (2).
Hướng dẫn giải :
Amoniac(NH3); metyamin (CH3NH2); anilin( C6H5NH2); dimetyl amin(CH3 – NH – CH3)
Dựa vào tính chất trên : anilin có vòng benzen(gốc phenyl) ⇒ Tính bazơ yếu nhất
NH3 ở mức trung gian > C6H5NH2
Amin bậc I (CH3NH2) < Amin bậc 2 (NH3 – NH –NH3)
⇒Thứ tự : C6H5NH2 < CH3 < CH3NH2<(CH3)2NH
→ Đáp án B
Dạng 3: Xác định số nhóm chức amin
Tùy theo số nhóm chức amin mà tác dụng với axit theo tỉ lệ xác định
Ví dụ 1 : X là một hợp chất hữu cơ mạch hở chứa các nguyên tố C, H và N trong đó N chiếm 23,72%. Biết X tác dụng với dung dịch HCl theo tỉ lệ mol 1: 1. Công thức phân tử của X là:
A. CH5N
B. C2H7N
C. C3H9N
D. C4H11N
Hướng dẫn giải :
Vì n HCl : n X = 1: 1 ⇒ Phân tử chứa 1 nhóm chức amin, tức có 1 nguyên tử N
⇒ mX = 14 : 23,72% = 59
Gọi CTPT X là: CxHyNH2
⇒ 12x + y + 16 = 59
⇒ 12x + y =43 ⇒ x = 3; y = 7
→ Đáp án C
Ví dụ 2 : Để trung hòa 50 ml dung dịch đimetyl amin cần dùng 40 ml dung dịch HCl 0,1M. Nồng độ dung dịch amin và khối lượng muối thu được là:
A. 0,02M và 0,33g
B. 0,04M và 0,33g
C. 0,04 và 0,238g
D. 0,02 và 0,238g
Hướng dẫn giải :
nHCl = 0,004 ⇒ namin = 0,002 ( amin 2 chức)
CM amin = 0,002 : 0,05 = 0,04M
Áp dụng định luật bảo toàn khối lượng :
mmuối = mamin + mHCl = 0,002. 46 + 0,004.36,5 = 0,238g
→ Đáp án C
Dạng 4: Phản ứng cháy của amin
Phương pháp :
Lưu ý :
Khi đốt cháy 1 amin ngoài không khí thì:
nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 có sẵn trong không khí
Amin no đơn chức mạch hở: CnH2n+3N
Amin no 2 chức mạch hở: CnH2n+4N2
Ví dụ 1 : Đốt cháy hoàn toàn a mol hỗn hợp X gồm 2 amin no đơn chức mạch hở liên tiếp nhau thu được 5,6 lít CO2 (đktc) và 7,2 g H2O . Giá trị của a là :
A. 0,05 mol
B.0,1 mol
C.0,15 mol
D.0,2 mol
Công thức 2 amin đó là:
A. C2H5NH2 và C3H7NH2
B. C3H7NH2 và C4H9NH2
C. CH3NH2 và C2H5NH2
D. C4H9NH2 và C5H11NH2
Hướng dẫn giải :
→ Đáp án B
Hướng dẫn giải :
n CO2 = 0,1n− = 0,25 mol ⇒ n− = 2,5
n = 2 và n = 3 ⇒ C2H5NH2 và C3H7NH2
→ Đáp án A
Ví dụ 2 : Khi đốt cháy hoàn toàn một amin đơn chức X, người ta thu được 10,125g H2O; 8,4 lít CO2 và 1,75 lít N2 ( các thể tích khí đo ở đktc, và thể tích N2 trong không khí chiếm 20% thể tích N2 thu được). Công thức của phân tử X là:
A. C4H11N B. C2H7N
C. C3H9N D. C5H13N
Hướng dẫn giải :
→ Đáp án C
Dạng 5: Amin tác dụng với muối của kim loại
Một số muối dễ tạo kết tủa hidroxit với dung dịch amin
Ví dụ: AlCl3 + 3CH3NH2 + 3H2O → Al(OH)3 + 3CH3NH3Cl
Lưu ý :
- Tương tự như NH3 các amin cũng tạo phức chất tan với Cu(OH)2, Zn(OH)2, AgCl…
Ví dụ: Khi sục khí CH3NH2 tới dư vào dd CuCl2 thì ban đầu xuất hiện kết tủa Cu(OH)2 màu xanh nhạt, sau đó kết tủa Cu(OH)2 tan trong CH3NH2 dư tạo thành dd phức [Cu(CH3NH2)4](OH)2 màu xanh thẫm.
2CH3NH2 + CuCl2 + H2O → Cu(OH)2 + 2CH3NH3Cl
Cu(OH)3 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2
- Anilin và amin thơm không có phản ứng này
Ví dụ 1 : Chất phản ứng với FeCl3 cho kết tủa là:
A. CH3NH2
B. CH3COOCH3
C. CH3COOH
D. CH3OH
→ Đáp án A
Ví dụ 2 : Cho 9,3g amin bậc 1 phản ứng với dung dịch FeCl3 dư thu được 10,7g kết tủa. Công thức của Amin đó là:
A. CH3NH2
B. C2H5NH2
C. C3H7NH2
D.C4H9NH2
Hướng dẫn giải :
→ Đáp án A
Dạng 6: Anilin
Phương pháp : Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom tạo ra kết tuả trắng 2, 4, 6 tribromanilin ( phản ứng nhận biết anilin)
Ví dụ 1 : Để phân biệt anilin và etylamin đựng trong 2 lọ riêng biệt, ta dùng thuốc thử nào sau đây?
A. Dung dịch Br2
B. Dung dịch HCl
C. Dung dịch NaOH
D. Dung dịch AgNO3
Hướng dẫn giải :
Anilin phản ứng với nước Br2, tạo kết tủa trắng H2NC6H2Br3
→ Đáp án C
Ví dụ 2: Có ba chất lỏng: benzen, anilin và stiren đựng riêng biệt trong ba lọ mất nhãn. Thuốc thử để nhận biết ba chất lỏng trên là:
A. Nước brom
B. Giấy quỳ tím
C. Dung dịch phenolphtalein
D. Dung dịch NaOH
Hướng dẫn giải :
- Stiren làm mất màu nước brom :
C6H5 – CH = CH2 + Br2 → C6H5 – CHBr – CH2Br
- Anilin tạo kết tủa trắng :
C6H5-NH2 + 3Br2 → C6H2(Br)3-NH2↓ + 3HBr
- Benzen không có hiện tượng gì
→ Đáp án A
Dạng 7: Phản ứng khử amin bằng HNO2
Phương pháp :
- Amin bậc 1 phản ứng với HNO2 ở nhiệt độ thường tạo ra ancol hoặc phenol giải phóng khí N2
RNH2 + HONO → ROH + N2 + H2O
- Anilin và amin thơm phản ứng với HNO2 ở nhiệt độ thấp (0-5°C) tạo muối điazoni
Ví dụ 1: Hỗn hợp 1,07g hai amin đơn chức bậc nhất kế tiếp nhau trong dãy đồng đẳng phản ứng vừa hết với axit nitro ở nhiệt độ thường tạo nên dung dịch X. Cho X tác dụng với Na dư thu được 0,03 mol H2. Xác định công thức 2 amin:
A. C3H7NH2 và C4H9NH2
B. C2H5NH2 và C3H7NH2
C. CH3NH2 và C2H5NH2
D. CH3NH2 và C3H7NH2
Hướng dẫn giải :
Đặt công thức chung của 2 amin là: R−NH2
R−NH2 + HONO → R−OH + N2 + H2O
X gồm R−OH và H2O phản ứng với Na:
nR−OH + nH2O = 2nH2 = 0,06
⇒ nR−OH = nH2O = 0,03 mol = n R−NH2
⇒ R−OH = 1,07 : 0,03 = 35,6 ⇒ R− = 18,6
⇒ -CH3 (15) và -C2H5 (29)
→ Đáp án C
Ví dụ 2: Muối C6H5N2+Cl- (phenylđiazoni clorua) được sinh ra khi cho C6H5N2 (anilin) tác dụng với NaNO2 trong dung dịch HCl ở nhiệt độ thấp (0-5°C). Để điều chế được 14,05 gam C6H5N2+Cl-(với hiệu suất 100%), lượng C6H5N2 và NaNO2 cần dùng vừa đủ là:
A. 0,1 mol và 0,4 mol.
B. 0,1 mol và 0,2 mol.
C. 0,1 mol và 0,1 mol.
D. 0,1 mol và 0,3 mol.
Hướng dẫn giải :
nC6H5N2Cl = 0,1 mol
nC6H5N2 = nNaNO2 = nC6H5N2Cl = 0,1 mol
→ Đáp án C