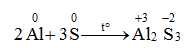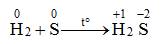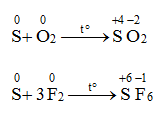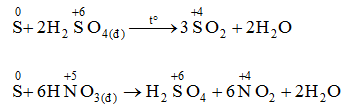Tính chất hóa học của Lưu huỳnh (S) - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Lưu huỳnh (S) sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Lưu huỳnh (S), tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Lưu huỳnh (S). Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Lưu huỳnh (S).
Lưu huỳnh (S): tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng
I. Định nghĩa
- Lưu huỳnh là một phi kim
- Kí hiệu: S
- Cấu hình electron: 1s22s22p63s23p4 hay [Ne]3s23p4
- Số hiệu nguyên tử: Z = 16
- Khối lượng nguyên tử: 32
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 16, nhóm VIA
+ Chu kì: 3
- Đồng vị: Lưu huỳnh có 4 đồng vị bền là 3216S, 3316S, 3416S và 3616S
- Độ âm điện: 2,58
II. Tính chất hóa học
Nhận xét: khi tham gia phản ứng hóa học, S thể hiện tính oxi hóa hoặc tính khử
1. Tác dụng với kim loại
S có thể tác dụng với nhiều kim loại ở nhiệt độ cao
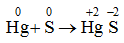
2. Tác dụng với hiđro
Trong các phản ứng trên, số oxi hóa của S giảm từ 0 xuống -2 → S thể hiện tính oxi hóa
3. Tác dụng với phi kim
Ở điều kiện thích hợp, S tác dụng được với một số phi kim như oxi, clo, flo,…
4. Tác dụng với hợp chất
Trong các phản ứng trên, số oxi hóa của S tăng từ 0 lên +4 hoặc +6 → S thể hiện tính khử

III. Tính chất vật lí & nhận biết
- Lưu huỳnh có 2 dạng thù hình là lưu huỳnh đơn tà và lưu huỳnh tà phương
|
Lưu huỳnh đơn tà (Sβ) |
Lưu huỳnh đơn tà (Sα) |
|
|
Nhiệt độ nóng chảy |
119oC |
113oC |
|
Nhiệt độ sôi |
Từ 95,5 đến 119oC |
Dưới 95,5oC |
|
Khối lượng riêng |
1,96 gam/cm3 |
2,07 gam/cm3 |
- Ảnh hưởng của nhiệt độ tới cấu trúc phân tử của S
Rắn (S8 – mạch vòng) 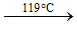
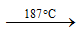
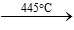
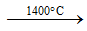
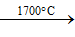
- Để đơn giản, trong các phản ứng hóa học người ta sử dụng kí hiệu S
IV. Trạng thái tự nhiên
- Trong tự nhiên, S tồn tại dưới nhiều dạng:
+ Đơn chất: trong các mỏ S
+ Hợp chất: FeS2 (quặng pirit sắt); muối sunfat, muối sunfua,…
+ Là thành phần hợp chất hữu cơ,…
V. Khai thác
1. Phương pháp Frasch
Để khai thác lưu huỳnh tự do trong lòng đất, người ta dùng hệ thống thiết bị nén nước siêu nóng (khoảng 170oC) vào vỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên mặt đất.
2. Sản xuất lưu huỳnh từ hợp chất
2H2S + O2 (thiếu) → 2S + 2H2O
2H2S + SO2 → 3S + 2H2O
VI. Ứng dụng
Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp
- 90% lưu huỳnh dùng để sản xuất axit sunfuric
- 10% lưu huỳnh còn lại dùng để lưu hóa cao su, sản xuất chất tẩy trắng, chế tạo diêm,….
VII. Các hợp chất quan trọng của lưu huỳnh
- Lưu huỳnh đioxit (SO2), lưu huỳnh trioxit (SO3)
- Hiđro sunfua, axit sufuhiđric (H2S )
- Axit sunfuric (H2SO4 )