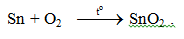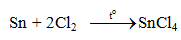Tính chất hóa học của Thiếc (Sn) - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Thiếc (Sn) sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Thiếc (Sn), tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Thiếc (Sn). Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Thiếc (Sn).
Thiếc (Sn): tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng
I. Định nghĩa
- Thiếc là một kim loại màu trắng bạc, kết tinh cao, dễ uốn, dễ dát mỏng. Khi một thanh thiếc bị bẻ cong, âm thanh nứt vỡ có thể nghe được do sóng tinh của các tinh thể.
- Kí hiệu: Sn
- Cấu hình electron: [Kr]4d105s25p2
- Số hiệu nguyên tử: 50
- Khối lượng nguyên tử: 199 g/mol.
- Vị trí trong bảng tuần hoàn
+ Ô: số 50
+ Nhóm: IVA
+ Chu kì: 5
- Đồng vị: Thường 118Sn, 120Sn.
- Độ âm điện: 1,96
II. Tính chất hóa học
- Thiếc là kim loại có tính khử yếu hơn kẽm và niken. Phụ thuộc vào chất oxi hóa mà thiếc có thể thể hiện số oxi hóa +2 hay +4.
Sn → Sn2+ + 2e
Sn → Sn4+ + 4e
a. Tác dụng với phi kim
- Tác dụng với oxi:
- Tác dụng với halogen.
b. Tác dụng với axit
+ Tác dụng với dung dịch HCl và H2SO4 loãng
Sn + H2SO4 → SnSO4 + H2
+ Tác dụng với H2SO4 và HNO3 đặc
Sn + 2H2SO4(đặc) → SnO2 + 2SO2 + 2H2O.
Sn + 4HNO3 (đặc) → SnO2 + 4NO2 + 2H2O.
4Sn + 10HNO3 (rất loãng) → 4Sn(NO3)2 + NH4NO3 + 3H2O.
c. Tác dụng với dung dịch kiềm đặc
Sn + NaOH (đặc, nguội) + 2H2O → Na[Sn(OH)3 ] + H2
Sn + 2NaOH (đặc) + 4H2O → Na2 [Sn(OH)6] + 2H2 .

III. Tính chất vật lí & nhận biết
1. Tính chất vật lí
- Thiếc tồn tại ở hai dạng thù hình là thiếc trắng và thiếc xám, hai dạng này có thể biến đổi qua lại lẫn nhau phụ thuộc vào nhiệt độ.
- Ở điều kiện thường, thiếc là kim loại màu trắng bạc, có khối lượng riêng lớn, D = 7,92 g/cm3.
2. Nhận biết
- Sử dụng dung dịch kiềm đặc, có khí không màu thoát ra
Sn + NaOH (đặc, nguội) + 2H2O → Na[Sn(OH)3 ] + H2
IV. Trạng thái tự nhiên
- Trong tự nhiên, thiếc có trữ lượng khoảng 6.10-4% trong vỏ trái đất, khoáng vật chính là caxiterit: SnO2.
V. Điều chế
- Thiếc được sản xuất từ việc khử quặng thiếc với cacbon trong lò lửa quặt.
SnO2 + 2C → Sn + 2CO
VI. Ứng dụng
- Thiếc được dùng để tráng lên về mặt các vật bằng thép, vỏ hộp thực phẩm, nước giải khát, có tác dụng chống ăn mòn, tạo vẻ đẹp không độc hại Thiếc dùng chế tạo hợp kim.
- Lá thiếc mỏng dùng trong tụ điện, hợp kim thiếc – chì dùng để hàn.
- SnO2 dùng làm men trong công nghiệp gốm sứ và thủy tinh làm mờ.
VII. Các hợp chất quan trọng của Sn
Thiếc (II) clorua: SnCl2
Thiếc đioxit: SnO2