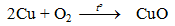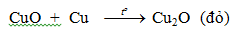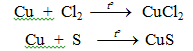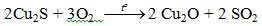Tính chất hóa học của Đồng (Cu) - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Đồng (Cu) sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Đồng (Cu), tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Đồng (Cu). Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Đồng (Cu).
Đồng (Cu): tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng
I. Định nghĩa
- Đồng là nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Cu và số nguyên tử bằng 29. Đồng là kim loại dẻo có độ dẫn điện và dẫn nhiệt cao. Nó được sử dụng làm chất dẫn nhiệt và điện, vật liệu xây dựng, và thành phần của các hợp kim của nhiều kim loại khác nhau.
- Kí hiệu: Cu
- Cấu hình electron: 1s22s22p63s23p63d104s1 hay [Ar]3d104s1.
- Số hiệu nguyên tử: 29
- Khối lượng nguyên tử: 64 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 29
+ Nhóm: IB
+ Chu kì: 4
- Đồng vị: 63Cu, 64Cu, 65Cu.
- Độ âm điện: 1,9
II. Tính chất hóa học
- Là kim loại kém hoạt động, có tính khử yếu.
Tác dụng với phi kim:
- Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
- Khi tiếp tục đun nóng tới (800-1000oC)
- Tác dụng với Cl2, Br2, S...
Tác dụng với axit:
- Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
- Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
- Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
Tác dụng với dung dịch muối:
- Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag

III. Tính chất vật lí & nhận biết
1. Tính chất vật lí:
- Là kim loại màu đỏ, dẻo, dễ kéo sợi và tráng mỏng.
- Dẫn điện và nhiệt rất cao (chỉ kém hơn bạc). D = 8,98g/cm3; t0nc= 1083oC
2. Nhận biết
- Đơn chất đồng có màu đỏ, các hợp chất của đồng ở trạng thái dung dịch có màu xanh đặc trưng.
- Hòa tan Cu vào dung dịch HNO3 loãng, thấy thu được dung dịch có màu xanh lam, thoát ra khí không màu hóa nâu trong không khí (NO).
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
IV. Trạng thái tự nhiên
- Hầu hết đồng được khai thác hoặc chiết tách ở dạng đồng sunfua từ các mỏ đồng. Khai thác lộ thiên chứa từ 0,4 đến 1,0% đồng.
V. Điều chế
- Xuất phát từ việc tinh chế quặng đồng
Ôxit đồng được chuyển thành đồng blister theo phản ứng nung:
2Cu2O → 4Cu + O2
VI. Ứng dụng
- Dựa vào tính dẻo, dẫn điện, dẫn nhiệt, bền của đồng và hợp kim:
1. Đồng thau : hợp kim Cu-Zn, có tính cứng và bền hơn Cu, dùng chế tạo chi tiết máy.
2. Đồng bạch : hợp kim Cu-Ni, có tính bền, đẹp, không bị ăn mòn trong nước biển, dùng trong công nghiệp tàu thủy.
3. Đồng thanh : hợp kim Cu-Sn, dùng chế tạo máy móc, thiết bị.
4. Hợp kim Cu-Au : dùng để trang trí.
VII. Các hợp chất quan trọng của Đồng
- Đồng (II) oxit: CuO
- Đồng(II) hiđroxit: Cu(OH)2
- Muối Cu(II): CuCl2, CuSO4, Cu(NO3)2.....