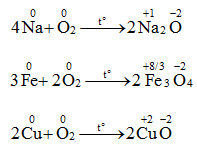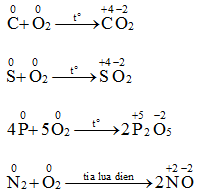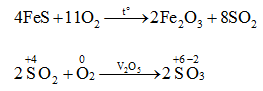Tính chất hóa học của Oxi (O) - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Oxi (O) sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Oxi (O), tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Oxi (O). Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Oxi (O).
Oxi (O): tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng
I. Định nghĩa
- Oxi là một phi kim.
- Kí hiệu: O – CTPT : O2
- Cấu hình electron: 1s22s22p4
- Số hiệu nguyên tử: Z = 8
- Khối lượng nguyên tử: 16
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 8, nhóm VIA
+ Chu kì: 2
- Đồng vị: Oxi có 3 đồng vị bền là 168O , 178O , 188O
- Độ âm điện: 3,44
II. Tính chất hóa học
Nhận xét: Oxi là một chất oxi hóa mạnh, tính phi kim chỉ thua mỗi flo, không thể hiện tính khử
O2 + 4e → 2O2-
1. Tác dụng với kim loại
Oxi oxi hóa được hầu hết kim loại trừ Ag, Au và Pt
2. Tác dụng với phi kim
Oxi tác dụng với nhiều phi kim, trừ halogen
3. Tác dụng với hợp chất
C2H5OH + 3O2 → 2CO2 + 3H2O

III. Tính chất vật lí & nhận biết
- Oxi là chất khí không màu, không mùi, hơi nặng hơn không khí ( d = 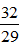
- Ở áp suất thường, oxi hóa lỏng ở -183oC
- Khí oxi ít tan trong nước.
IV. Trạng thái tự nhiên
- Trong tự nhiên, oxi tồn tại ở cả dạng đơn chất và hợp chất.
- Ở dạng đơn chất, oxi có trong không khí, chiếm khoảng 20% thể tích không khí. Oxi trong không khí là sản phẩm của quá trình quang hợp của cây xanh. Nhờ sự quang hợp của cây xanh mà lượng khí oxi trong không khí hầu như không đổi.
6CO2 + 6H2O 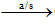
V. Điều chế
1. Trong phòng thí nghiệm
Nguyên tắc: Phân hủy các chất giàu O, kém bền nhiệt như H2O2, KMnO4, KClO3,...
2KMnO4 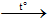
2KClO3 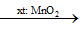
2H2O2 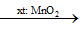
2. Trong công nghiệp
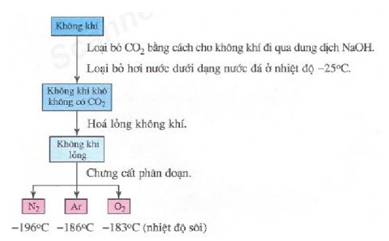
a. Từ không khí
* Phương pháp: chưng cất phân đoạn không khí lỏng
b. Từ nước
* Phương pháp: điện phân nước
2H2O 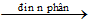
VI. Ứng dụng
- Là chất duy trì sự sống, sự cháy
- Là nguyên liệu, nhiên liệu cần thiết cho các hoạt động công nghiệp và sinh hoạt.
VII. Các hợp chất quan trọng của oxi
- ozon ( O3 ) và hiđro peoxit (H2O2 )