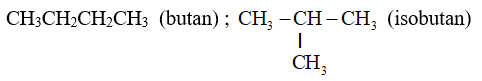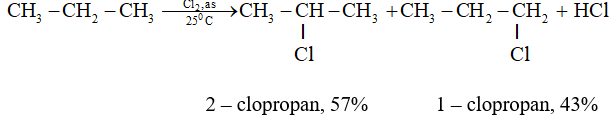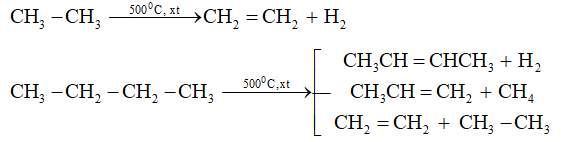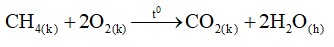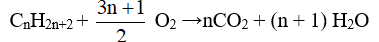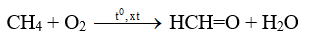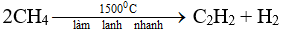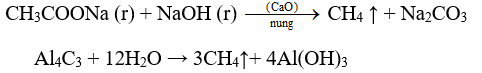Tính chất hóa học của Ankan - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Ankan sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Ankan, tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Ankan. Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Ankan.
Tính chất của Ankan: Tính chất hóa học, vật lí, điều chế, ứng dụng
I. Đồng đẳng, đồng phân
1.Đồng đẳng
- Ankan: metan (CH4), etan (C2H6), propan ( C3H8 ), các butan ( C4H10), các pentan ( C5H12), ... có công thức chung là CnH2n+2 (n ≥ 1). Chúng hợp thành dãy đồng đẳng gọi là dãy đồng đẳng của metan.
2.Đồng phân
a) Đồng phân mạch cacbon
- Ở dãy đồng đẳng của metan, từ thành viên thứ tư trở đi, mỗi thành viên đều gồm nhiều đồng phân.
- Thí dụ: Ứng với công thức C4H10 (thành viên thứ tư của dãy đồng đẳng) có hai đồng phân cấu tạo.
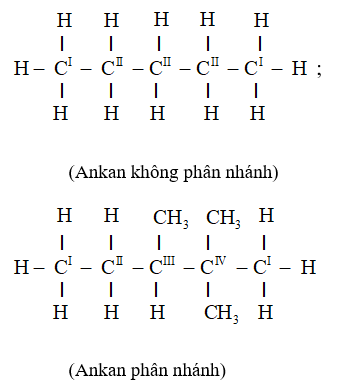
=> Nhận xét: Ankan từ C4H10 trở đi có đồng phân cấu tạo, đó là đồng phân mạch cacbon.
b) Bậc của cacbon
- Bậc của một nguyên tử C ở phân tử ankan bẳng số nguyên tử C liên kết trực tiếp với nó.
- Ankan mà phân tử chỉ chứa C bậc I và C bậc II (không chứa C bậc III và C bậc IV) là ankan không phân nhánh.
- Ankan mà phân tử có chứa C bậc III hoặc C bậc IV là ankan phân nhánh.
II. Danh pháp
1.Ankan không phân nhánh
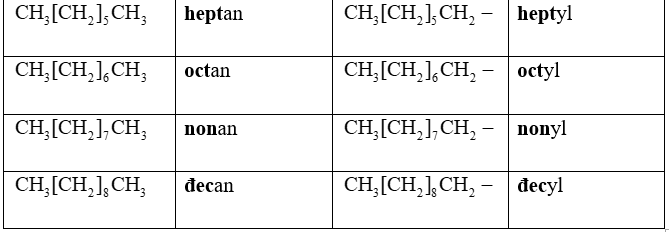
- Theo IUPAC, tên của 10 ankan không phân nhánh đầu tiên được gọi như sau:
Bảng 1.1. Tên mười ankan và nhóm ankyl không phân nhánh đầu tiên
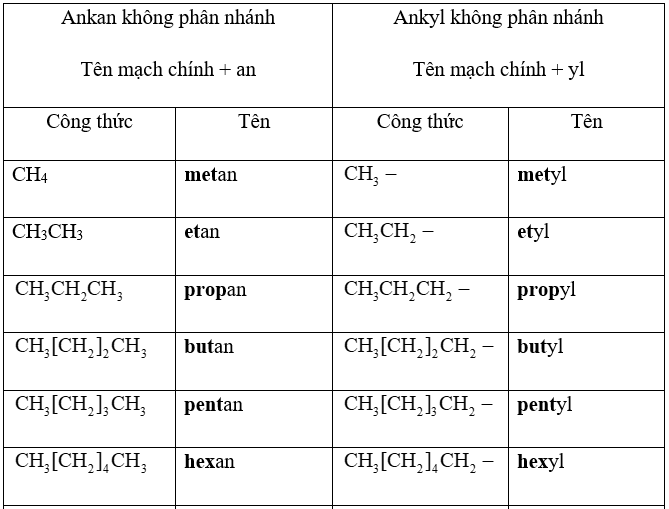
- Nhóm nguyên tử còn lại sau khi bớt một nguyên tử H từ phân tử ankan, có công thức CnH2n+1, được gọi là nhóm ankyl. Tên của nhóm ankyl không nhánh lấy từ tên của ankan tương ứng đổi đuôi an thành đuôi yl.
2.Ankan phân nhánh
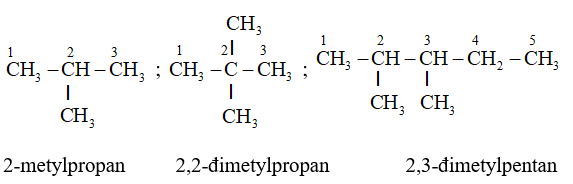
- Theo IUPAC, tên của ankan phân nhánh được gọi theo kiểu tên thay thế:
|
Số chỉ vị trí – Tên nhánh + Tên mạch chính + an |
+ Mạch chính là mạch dài nhất, có nhiều nhánh nhất. Đánh số các nguyên tử cacbon thuộc mạch chính bắt đầu từ phía phân nhánh sớm hơn.
+ Gọi tên mạch nhánh (tên nhóm ankyl ) theo thứ tự vần chữ cái. Số chỉ vị trí nhánh nào đặt ngay trước gạch nối với tên nhánh đó.
Thí dụ:
III. Cấu trúc phân tử
-Sự hình thành liên kết trong phân tử ankan.
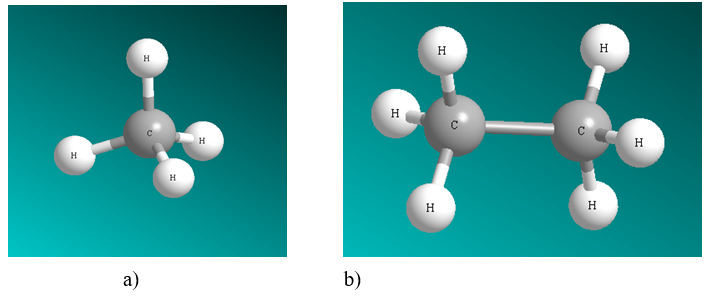
+ Hình 1.1. Sự hình thành liên kết ở CH4 (a) và ở phân tử C2H6 (b)
-Các nguyên tử C ankan ở trạng thái lai hóa sp3. Mỗi nguyên tử C nằm ở tâm của tứ diện mà 4 đỉnh là các nguyên tử H hoặc C, liên kết C-C, C-H đều là liên kết xích ma. Các góc hóa trị đều gần bằng 109,5 độ.
IV. Tính chất hóa học
1.Phản ứng thế
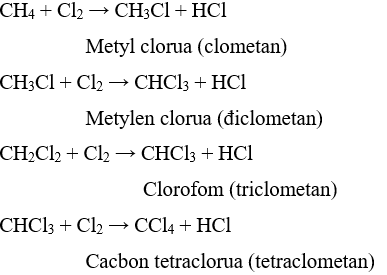
- Khi chiếu sáng hoặc đốt nóng hỗn hợp metan và clo xảy ra phản ứng thế lần lượt các nguyên tử hiđro bằng clo:
- Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự như metan.
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữa cơ có chứa halogen gọi là dẫn xuất halogen.
2.Phản ứng tách (gãy liên kết )
- Nhận xét: Dưới tác dụng của nhiệt và xúc tác (Cr2O3, Fe, Pt,... ), các ankan không những bị tách hiđro tạo thành hiđrocacbon không no mà còn bị gãy các liên kết C-C tạo ra các phân tử nhỏ hơn.
3.Phản ứng oxi hóa
-Metan cháy tạo thành khí cacbon đioxit và hơi nước.
-Phản ứng trên tỏa nhiều nhiệt. Hỗn hợp gồm một thể tích metan và hai thể tích oxi là hỗn hợp nổ mạnh.
-Các ankan đầu dãy đồng đẳng đều rất dễ cháy và tỏa nhiều nhiệt. Khí CO2, hơi nước và nhiệt tạo ra nhanh hơn nên có thể gây nổ.
-Nếu không đủ oxi, ankan bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO, muội than, không những làm giảm năng suất tảo nhiệt mà còn gây độc hại cho môi trường.
-Khi có xúc tác và nhiệt độ thích hợp, ankan bị oxi hóa không hoàn toàn tạo thành dẫn suất chứa oxi.
4.Phản ứng nhiệt phân

V. Tính chất vật lí
-Ở điều kiện thường, các ankan từ C1 đến C4 ở trạng thái khí, từ C5 đến khoảng C18 ở trạng thái lỏng, từ khoảng C18 trở đi ở trạng thái rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của ankan nói chung đều tăng theo số lượng nguyên tử cacbon trong phân tử tức là tăng theo phân tử khối. Ankan nhẹ hơn nước.
- Ankan không tan trong nước, khi trộn vào nước thì tách lớp nổi lên trên người ta nói chúng kị nước. Ankan là những dung môi không phân cực hòa tan tốt những chất không phân cực như dầu, mỡ... chúng là những chất ưa dầu mỡ và ưa bám dính quần áo, lông, da. Những ankan lỏng có thể thấm qua da và màng tế bào.
- Ankan đều là những chất không màu.
- Các ankan nhẹ nhất như metan, etan, propan là những khí không mùi. Ankan từ C5 – C10 có mùi xăng, từ C10– C16 có mùi dầu hỏa. Các ankan rắn rất ít bay hơi nên hầu như không mùi.
VI. Điều chế
a)Trong công nghiệp
- Metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ.
b)Trong phòng thí nghiệm
- Khi cần một lượng nhỏ metan, người ta nung natri axetat với vôi tôi xút, hoặc có thể cho nhôm cacbua tác dụng với nước:
VII. Ứng dụng
- Dùng làm nhiên liệu (CH4 dùng trong đèn xì để hàn, cắt kim loại).
- Dùng làm dầu bôi mỡ bôi trơn, chống gỉ. Sáp pha thuốc mỡ và đun nấu
- Dùng làm dung môi.
- Để tổng hợp nhiều chất hữu cơ khác: CH3Cl, CH2Cl2 , CCl4, CF2Cl2,…
- Đặc biệt từ CH4 điều chế được nhiều chất khác nhau: hỗn hợp CO + H2, amoniac, rượu metylic, anđehit fomic, ...