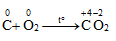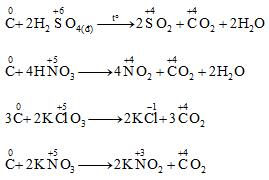Tính chất hóa học của Cacbon (C) - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của Cacbon (C) sẽ trình bày chi tiết, đầy đủ tính chất hóa học của Cacbon (C), tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của Cacbon (C). Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của Cacbon (C).
Cacbon (C): tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng
I. Định nghĩa
- Cacbon là một phi kim
- Kí hiệu: C
- Cấu hình electron: 1s22s22p2
- Số hiệu nguyên tử: Z = 6
- Khối lượng nguyên tử: 12
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 6, nhóm IVA
+ Chu kì: 2
- Đồng vị: Cacbon có 2 đồng vị bền là 126C và 136C
- Độ âm điện: 2,55
II. Tính chất hóa học (xét với cacbon vô định hình)
Nhận xét:
- Độ hoạt động hóa học: kim cương < than chì < cacbon vô định hình
- C là chất vừa có tính khử, vừa có tính oxi hóa
1. Tính khử
a. Khử oxi
Cacbon khử oxi khi đun nóng:
Ở nhiệt độ cao:
b. Khử oxit kim loại
- C khử oxit kim loại yếu, trung bình (ZnO → CuO)
2ZnO + C 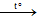
2CuO + C 
- C khử được một số oxit kim loại mạnh
CaO + 3C 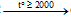
c. Khử nước
C + H2O 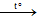
CO2 + C 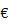
d. Khử một số hợp chất có tính oxi hóa mạnh

III. Tính chất vật lí & nhận biết
- Nguyên tố C có nhiều dạng thù hình như: kim cương, than chì, fluleren
|
Kim cương |
Than chì |
Fluleren |
|
- Là chất rắn trong suốt, không màu, lấp lánh rất đẹp - Rất bền, cứng nhất, nhiệt độ nóng chảy rất cao (3750oC) - Không dẫn điện, dẫn nhiệt kém |
- là chất rắn màu xám đen, có ánh kim, dẫn điện, dẫn nhiệt tốt - Nhiệt độ nóng chảy cao, bền - Mềm, nhờn, trơn |
- Có rất nhiều nguyên tử C VD: C60, C70,... - Có dạng khối cầu rỗng, hình trụ,… |
- Than gỗ, than xương, than muội, than cốc là than nhân tạo, cacbon vô định hình, là một dạng đặc biệt của than chì.
- Than đỗ, than xương: xốp, nhẹ vì có các lỗ nhỏ li ti, có khả năng hấp phụ khí, chất tan trong dung dịch → than hoạt tính: lọc nước, khí,…
IV. Trạng thái tự nhiên
- Trong tự nhiên, nguyên tố C có ở dạng
+ Đơn chất: kim cương, than chì (graphit)
+ Hợp chất: cơ thể sống, vỏ trái đất (đá vôi - CaCO3 , đolomit - CaCO3.MgCO3 , dầu mỏ, khí đốt – các hiđrocacbon ),…
V. Điều chế
CH4 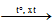
Gỗ 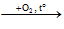
VI. Ứng dụng
|
Kim cương |
- làm đồ trang sức - làm đầu mũi khoan, dao cắt kính,… |
|
Than chì |
- làm điện cực, làm chén nung - làm ruột bút chì đen, chất phụ gia trong dầu mỡ bôi trơn |
|
Than muội |
- làm mực in, chất tạo màu đen và chất độn cho cao su, chất dẻo,… |
|
Than cốc |
- làm chất khử điều chế kim loại |
|
Than gỗ, than xương |
- làm than hoạt tính: lọc khí, lọc nước - làm chất khử điều chế kim loại, làm nhiên liệu,… |
VII. Các hợp chất quan trọng của cacbon
- Cacbon monooxit (CO)
- Cacbon đioxit ( CO2)
- H2CO3 , muối cacbonat.