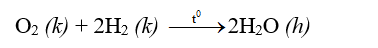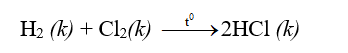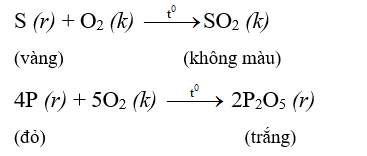Tính chất hóa học của phi kim - điều chế, ứng dụng, cách nhận biết, tính chất vật lí
Với Tính chất hóa học của phi kim sẽ trình bày chi tiết, đầy đủ tính chất hóa học của phi kim, tính chất vật lí, cách điều chế, cách nhận biết và ứng dụng của phi kim. Hi vọng với bài học này học sinh sẽ nắm vững được kiến thức trọng tâm về Tính chất hóa học của phi kim.
Tính chất của Phi kim: Tính chất hóa học, vật lí, điều chế, ứng dụng
I. Tính chất hóa học
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối:
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro
+ Khí oxi tác dụng với hiđro tạo thành hơi nước:
- Clo tác dụng với hiđro
+ Hiđro cháy trong khí clo tạo thành khí không màu. Màu vàng lục của khí clo biến mất. Giấy quỳ tím hóa đỏ.
+ Khí clo đã phản ứng mạnh với hiđro tạo thành khí hiđro clorua không màu. Khí này tan trong nước tạo thành dung dịch axit clohiđric và làm quỳ tím hóa đỏ.
- Ngoài ra, nhiều phi kim khác như C, S, Br2,... tác dụng với hiđro cũng tạo thành hợp chất khí.
=>Phi kim phản ứng với hiđro tạo thành hợp chất khí.
3. Tác dụng với oxi
=>Nhiều phi kim tác dụng với oxi tạo thành oxit axit.
4. Mức độ hóa học của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro. Flo, oxi, clo là những phi kim hoạt động mạnh, flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.
II. Tính chất vật lí
- Ở điều kiện thường, phi kim tồn tại ở cả ba trạng thái: trạng thái rắn như lưu huỳnh, cacbon, photpho ... ; trạng thái lỏng như brom; trạng thái khí như oxi, nitơ, hiđro, clo ...
- Phần lớn các nguyên tố phi kim không dẫn được điện, dẫn nhiệt và có nhiệt độ nóng chảy thấp. Một số phi kim độc như clo, brom, iot.
II. Tính chất hóa học
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối:
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro
+ Khí oxi tác dụng với hiđro tạo thành hơi nước:
- Clo tác dụng với hiđro
+ Hiđro cháy trong khí clo tạo thành khí không màu. Màu vàng lục của khí clo biến mất. Giấy quỳ tím hóa đỏ.
+ Khí clo đã phản ứng mạnh với hiđro tạo thành khí hiđro clorua không màu. Khí này tan trong nước tạo thành dung dịch axit clohiđric và làm quỳ tím hóa đỏ.
- Ngoài ra, nhiều phi kim khác như C, S, Br2,... tác dụng với hiđro cũng tạo thành hợp chất khí.
=>Phi kim phản ứng với hiđro tạo thành hợp chất khí.
3. Tác dụng với oxi
=>Nhiều phi kim tác dụng với oxi tạo thành oxit axit.
4. Mức độ hóa học của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro. Flo, oxi, clo là những phi kim hoạt động mạnh, flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.