Ancol
Ancol Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Ancol
Ancol
I. Định nghĩa, phân loại
1. Định nghĩa
Ancol là nhứng HCHC trong phân tử có nhóm hiđroxyl (- OH) liên kết trực tiếp với nguyên tử cacbon no.
2. Phân loại
- Ancol no, đơn chức, mạch hở có CTPT là: CnH2n + 1OH hay CnH2n+2O (Đk với n ≥ 1).

II. Đồng phân, danh pháp
1. Đồng phân: Từ C3H8O mới có đồng phân.
- Đồng phân mạch cacbon.
- Đồng phân vị trí nhóm chức.
2. Danh pháp
a. Tên thông thường: Tên gọi= ancol + tên gốc hiđrocacbon + ic.
Ví dụ: C2H5OH: ancol etylic C6H5CH2OH : ancol benzylic
b. Tên thay thế: Tên gọi= tên hiđrocacbon tương ứng mạch chính + chỉ số vị trí nhóm OH + ol
III. Tính chất hoá học
1. Phản ứng thế nguyên tử hiđro của nhóm OH: (phản ứng đặc trưng của Ancol)
a. Tính chất chung của ancol: CTTQ: 2ROH + Na → 2RONa + H2
b. Tính chất đặc trưng của glixerol:
2C3H5 (OH)3 + Cu(OH)2 → [C3H5 (OH)2O]2Cu +H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau )
→Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH
a. Phản ứng với axit vô cơ:
C2H5OH + HBr to→ C2H5Br + H2O
b. Phản ứng tạo dien: dùng sản xuất cao su buna
2C2H5OH to→ C4H6 +H2 + 2H2O
(Đk: phải có xúc tác là Al2O3 + MgO hoặc ZnO/500oC)
3. Phản ứng tách H2O: (phản ứng đêhidrat hoá)
Chú ý:
+ CnH2n+1OH 170oC→ CnH2n(anken)+ H2O (ĐK n ≥ 2, theo quy tắc Zai-xép)
(ancol bậc càng cao thì càng dễ khử nước tạo anken)
Vd: CH3 – CH2 – OH 170oC→ CH2 = CH2 + H2O (phải là rượu no, đơn chức)
+ 2CnH2n+1OH 170oC→ CnH2n + 1OCnH2n + 1(ete) + H2O
(ancol bậc càng thấp thì càng dễ khử nước tạo ete)
Vd: 2C2H5OH 170oC→ C2H5 - O - C2H5 + H2O
Cách tính số ete = n(n+1)/2 (với n là số rượu)
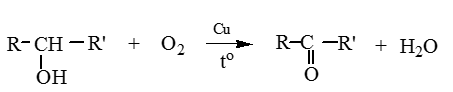
4. Phản ứng oxi hoá
a. Phản ứng oxi hoá hoàn toàn
CnH2n +2 + 3n/2O2 → nCO2 + (n +1)H2O
b. Phản ứng oxi hoá không hoàn toàn
ancol bậc I toC→ RCHO (anđehit) (CuO)
ancol bậc II toC→ xeton (CuO)
ancol bậc III toC→ khó bị oxi hoá. (CuO)
CH3 – CH2 – OH + CuO toC→ CH3 – CHO + Cu + H2O
CH3 – CH OH– CH3 + CuO toC→ CH3 – CO – CH3 + Cu + H2O
IV. Tính chất vật lí
- Các ancol có nhiệt độ sôi cao hơn các hiđcacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kêt hiđro →Anh hưởng đến độ tan.
-Từ C11 đến C12 ancol ở thể lỏng (khối lượng riêng d < 1), từ C113 trở lên ở thể rắn.
- C11 đến C3 tan vô hạn trong nước vì có liên kiết H với nước.
- Độ rượu: = (Vancol nguyên chất / Vdd ancol). 100
V. Điều chế
1. Phương pháp tổng hợp
Anken + H2O toC→ ancol
a. Etanol Từ etilen CH2 = CH2 + H2O → CH3CH2OH
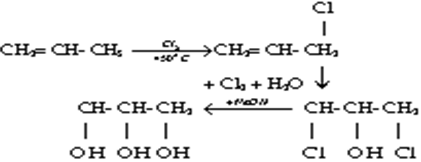
b. Glixerol
- Glixerol còn được sản xuất bằng phương pháp thuỷ phân chất béo.
2. Phương pháp sinh hoá: từ tinh bột, đường ...
(C6H5OH)n toC→ C6H12O6 enzim→ C2H5OH