Phản ứng cộng H2 của anken
Phản ứng cộng H2 của anken Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Phản ứng cộng H2 của anken
Phản ứng cộng H2 của anken
I. Phương pháp giải
CnH2n + H2 → CnH2n+2
+ Tỉ lệ phản ứng luôn là 1:1
+ Khối lượng trước và sau phản ứng luôn bằng nhau
+ Số mol sau phản ứng luôn giảm (vì mất H2 ) → nH2 p/ứ = nđ - ns

II. Ví dụ
Bài 1: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Tìm công thức cấu tạo của anken.
Trả lời
Gọi số mol hổn hợp X là 1 mol
Ta có M ̅X = 9,1. 2 = 18,2 → mX = 18,2. 1 = 18,2 g = mY
Mà M ̅Y = 13. 2 = 26 → nY = 18,2/26= 0,7 mol
→ nH2 pư = 1 – 0,7 = 0,3 mol = nanken → nH2 bđ = 0,7 mol
Manken = (18,2-0,7.2)/0,3 = 14n → n = 4 → CTPT của anken là C4H8
Anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất
=> CTCT của anken là: CH3-CH=CH-CH3.
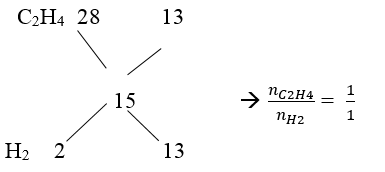
Bài 2: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Tính hiệu suất của phản ứng hiđro hoá?
A. 20%. B. 25%. C. 50%. D. 40
Trả lời
Ta có : M ̅X = 4. 3,75 = 15
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1mol → mX = 15. 1 = 15 g = mY
Mà M ̅Y = 5. 4 = 20 → nY = 15/20 = 0,75 mol → nH2 pư = 1 – 0,75 = 0,25 mol
→ H = 0,25/0,5.100% = 50 %