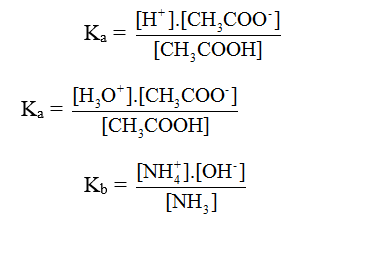Axit, bazo, muối. pH của dung dịch
Axit, bazo, muối. pH của dung dịch Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Axit, bazo, muối. pH của dung dịch
Axit, bazo, muối. pH của dung dịch
I. Axit, bazơ, muối
1. Axit và bazơ theo thuyết Areniut:
Axit: H2O → H+; Bazơ H2O → OH-
*Axit nhiều nấc:
VD: H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H++ HPO42-
HPO42- ⇌ H+ + PO43-
* Bazơ nhiều nấc:
VD: Mg(OH)2 ⇌ Mg(OH)+ + OH- ; Mg(OH)+ ⇌ Mg2+ + OH-
*Hiđroxit lưỡng tính:
A(OH)n : Zn(OH)2, Pb(OH)2, Sn(OH)2, Cu(OH)2, Al(OH)3, Cr(OH)3.
Phân li theo kiểu bazơ:
VD: Zn(OH)2 ⇌ Zn2+ + 2OH- ; Al(OH)3 ⇌ Al3+ + 3OH-
Phân li theo kiểu axit:
VD: Zn(OH)2 ⇌ ZnO22- + 2H+ ; Al(OH)3 ⇌ AlO2- + H3O+

2. Axit, bazơ theo Bronsted:
Axit là chất (hoặc ion) nhường proton H+.
Bazơ là chất (hoặc ion) nhận proton H+.
Chú ý:
Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4, ...) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb):
VD: CH3COOH ⇌ CH3COO- + H+
CH3COOH + H2O ⇌ CH3COO- + H+
VD: NH3 + H2O ⇌ NH4+ + OH-
Sự điện li của muối trong nước:
VD: Na2SO4 → 2Na+ + SO42-
Muối axit, muối trung hoà:
+ Muối axit: Là muối mà gốc axit còn H có khả năng cho proton.
+ Muối trung hoà: Là muối mà gốc axit không còn H có khả năng cho proton.
II. pH của dung dịch
| CÔNG THỨC | MÔI TRƯỜNG |
|
pH = - lg[H+] pOH = - lg[OH-] [H+].[OH-] = 10-14 pH + pOH = 14 pH = a => [H+] = 10-a pOH = b => [OH+] = 10-b |
pH < 7 → Môi trường axít pH > 7 → Môi trường bazơ pH = 7 →Môi trường trung tính [H+] càng lớn ↔ Giá trị pH càng bé [OH-] càng lớn ↔ Giá trị pH càng lớn |