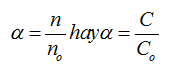Tính pH của dung dịch axit – bazơ yếu
Tính pH của dung dịch axit – bazơ yếu Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Tính pH của dung dịch axit – bazơ yếu
Tính pH của dung dịch axit – bazơ yếu
I. Phương pháp giải
Tương tự như axit mạnh.
Sử dụng kết hợp công thức tính độ điện li α, hằng số điện li axit, bazo: Ka, Kb
- Độ điện li α của chất điện li là tỉ số giữa số phân tử phân li ra ion (n) và tổng số phân tử hòa tan (no)
- Hằng số phân li axit: HA ⇌ H+ + A-
- Hằng số phân li bazơ: BOH ⇌ B+ + OH-

II. Ví dụ
Bài 1: Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a. Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b. Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
Trả lời
a. nNH4Cl = 1,07/53,5 = 0,02 => CM(NH4Cl) = 0,02/2 = 0,01 M
Phương trình điện li:
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01
Điện ly: x x x
Sau điện li: 0,01-x x x
Kb = x2/(0,01-x) = 1,8.10-5 => x = 4,24.10-4 => pH = 3,37
b. Phương trình điện li:
HCl → H+ + Cl+
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01 0,001
Điện ly x x x
Sau điện li: 0,01-x x x+0,001
Kb = (x.(x+0,001))/(0,01-x) = 1,8.10-5 => x = 3,69.10-4 => pH = 3,43
Bài 2: Dung dịch A chứa NH3 0,1M và NaOH 0,1M. Tính pH của dung dịch biết Kb của NH3 = 1,75.10-5.
Trả lời
Phương trình điện li
NaOH → Na+ + OH-
NH3 + H2O ⇌ NH4+ + OH+
Ban đầu: 0,1 0,1
Điện ly: x x x
Sau điện li: 0,1-x x x+0,1
Kb = (x.(0,1+x))/(0,1-x) = 1,75.10-5 => x = 1,75.10-3 => pOH = 4,76 => pH = 9,24