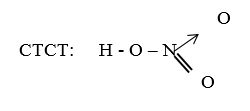Axit nitơric và muối nitrat
Axit nitơric và muối nitrat Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Axit nitơric và muối nitrat
Axit nitơric và muối nitrat
A. AXIT NITRIC
I. Cấu tạo phân tử:
- CTPT: HNO3
CTCT:
II. Tính chất hóa học
1. Tính axit: Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
- Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit : làm đỏ quỳ tím , tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
2. Tính oxi hóa:
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
a) Với kim loại:
HNO3 oxi hầu hết các kim loại( trừ vàng (Au) và platin(Pt) )
Vd:Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O.
3Cu + 8HNO3(l)→ 3Cu(NO3)2 + 2NO + 4H2O.
+ Fe, Al, Cr bị thụ động hóa trong dung HNO3 đặc nguội.
b) Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi :C, P, S...(trừ N2 và halogen)
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
c) Với hợp chất:
- H2S, Hl, SO2, FeO, muối sắt (II)... có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn. Ví dụ như :
3FeO + 10HNO3(d) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(d) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông... bốc cháy khi tiếp xúc với HNO3 đặc.
III. Tính chất vật lý
- Là chất lỏng không màu, D = 1.53g/cm3
- Axit nitric không bền, khi có ánh sang phân hủy một phần
4HNO3 → 4NO2 + O2 + 2H2O
- Axit nitric tan vô hạn trong nước.
V. Điều chế
1-Trong phòng thí nghiệm
NaNO3 (r) + H2SO4 (đ) to→ HNO3 + NaHSO4
Điện phân các muối nitrat của kim loại đứng sau H+ của nước ( sau Al)
M(NO3)x +x/2 H2O đp→ M + x/4 O2 + xHNO3
2- Trong công nghiệp: NH3 → NO → NO2 → HNO3

B. MUỐI NITRAT
I. Tính chất vật lý: Dễ tan trong nước , là chất điện li mạnh trong dung dịch phân ly hoàn toàn thành các ion.
Ca(NO3)2 → Ca2+ + 2NO3-
- Ion NO3- không có
II. Tính chất hóa học:
Các muối nitrat của kim loại kiền và kiềm thổ có môi trường trung tính, muối của kim loại khác có môi trường axit (pH < 7)
1 . Nhiệt phân muối Nitrat
a) Muối nitrat của các kim loaị hoạt động (trước Mg):
Nitrat → Nitrit + O2
vd: 2KNO3 to→ 2KNO2 + O2
b) Muối nitrat của kim loại từ Mg → Cu:
Nitrat → Oxit kim loại + NO2 + O2
vd: 2Cu(NO3)2 to→ 2CuO + 4NO2 + O2
c) Muối của những kim lạo kém hoạt (sau Cu ) :
Nitrat → kim loại + NO2 + O2
vd: 2AgNO3 to→ 2Ag + 2NO2 + O2
2. Ion NO3- trong H+ (axit)
NO3- + 4H+ + 3e → NO + 2H2O
Ví dụ: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
3. Ion NO3- trong OH-(kiềm) : OXH được các kim loại lưỡng tính:
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3↑
4. Nhận biết ion nitrat (NO3-)
Trong môi trường axit , ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
Hiện tượng : dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2 NO↑ + 4H2O
2NO + O2 ( không khí) → 2NO2 ( màu nâu đỏ)