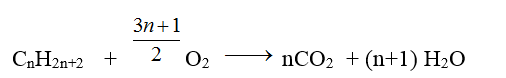Phản ứng oxi hóa ankan (đốt cháy)
Phản ứng oxi hóa ankan (đốt cháy) Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Phản ứng oxi hóa ankan (đốt cháy)
Phản ứng oxi hóa ankan (đốt cháy)
I. Phương pháp giải
Phản ứng đốt cháy có dạng ankan:
Suy ra: ankan khi cháy cho nCO2 < nH2O
nankan = nH2O – nCO2 ; nO2pu = nH2O + 1/2nCO2 ; mankan = mC + mH
* Nếu có hỗn hợp gồm gồm hai ankan:
CnH2n+2: x mol
CmH2m+2: y mol
Gọi công thức trung bình của hai ankan là:

II. Ví dụ
Bài 1: Đốt cháy hoàn toàn 6,8g hỗn hợp khí X gồm: ankan A và CH4, sản phẩm cháy dẫn vào bình 1 đựng P2O5 và bình 2 đựng 1000 ml Ba(OH)2 0,5M. Sau thí nghiệm khối lượng bình 1 tăng 12,6g.
a. Tìm công thức phân tử của A, biết VA : VCH4 = 2 : 3.
b. Tính khối lượng các chất trong X.
c. Tính khối lượng muối tạo thành.
Trả lời
VA: VCH4 = 2 : 3 => nA : nCH4 = 2x : 3x
Khối lượng bình 1 tăng là khối lượng của H2O: nH2O = 12,6/18 = 0,7 mol
a. Gọi CTPT của ankan là CnH2n+2
CH4 + 2O2 → CO2 + 2H2O
Ta có: (14n + 2).2x + 16.3x = 6,8 (1) ; (n + 1).2x + 6x = 0,7(2)
Từ 1, 2 => x = 0,05 và nx = 0,15 => n = 3
Vậy CTPT của A là C3H8
b. Khối lượng của mỗi an kan trong hỗn hợp X là
mC3H8 = 2.0,05.44 = 4,4 gam => mCH4 = 6,8 – 4,4 = 2,4 gam
c. Số mol CO2 tạo thành là nCO2 = 2.0,15 + 3.0,05 = 0,45 mol
Số mol Ba(OH)2 là: nBa(OH)2 = 1.0,5 = 0,5 mol
T = 1/0,25 = 2,22 => chỉ tạo muối BaCO3
Khối lượng muối tạo thành: mBaCO3 = 0,45.197 = 88,65 gam
Bài 2: Đốt cháy hoàn toàn 1 hidrocacbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. XĐ CTPT của A.
Trả lời
Khối lượng bình 1 tăng là khối lượng của H2O => nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 => nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O => hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
→ n = 0,08/0,02 = 4
CTPT của A là C4H10