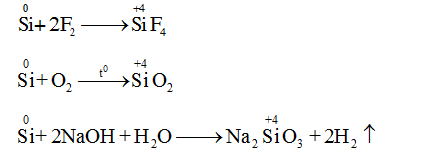Silic
Silic Hóa học lớp 11 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Silic
Silic
I. Silic
1. Tính chất hóa học
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
a. Tính khử
b. Tính oxi hóa
Mg + Si to→ Mg2Si
2. Tính chất vật lý
- Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.

3. Điều chế
- Khử SiO2 ở nhiệt độ cao
SiO2 + 2Mg to Si + MgO
II. HỢP CHẤT CỦA SILIC
1. Silic đioxit
- SiO2 là chất ở dạng tinh thể.
- Tan chậm trong dung dịch kiềm đặc nóng, tan dể trong kiềm nóng chãy.
SiO2 + 2NaOH Na2SiO3 + H2O
- Tan được trong axit HF
SiO2 + 4HF → SiF4 + 2H2O
- Dựa vào tính chất này, người ta dùng dung dịch HF để khắc chử lên thủy tinh.
2. Axit silixic
- H2SiO3 là chất ở dạng keo, không tan trong nước. Khi mất một phần nước tạo thành vật liệu xốp là silicagen. Dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
- Axit silixic là axit yếu, yếu hơn cả axit cacbinic nên bị axit này đẩy ra khỏi dung dịch muối.
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
3. Muối silicat
- Đa số các muối silicat đều không tan, chỉ có muối silicat của kim loại kiềm tan được trong nước.
- Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng.