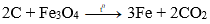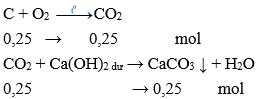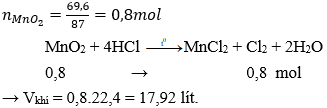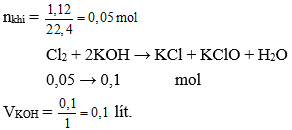Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết tổng hợp Hóa học lớp 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học chọn lọc năm 2020 mới nhất gồm tóm tắt lý thuyết và hơn 500 bài tập ôn luyện Hóa học 9. Hy vọng bộ tổng hợp lý thuyết Hóa học lớp 9 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 9
Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
A. Lý thuyết
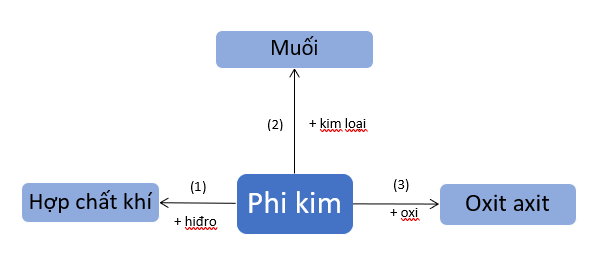
1. Tính chất hóa học của phi kim
2. Tính chất hóa học của 1 số phi kim cụ thể
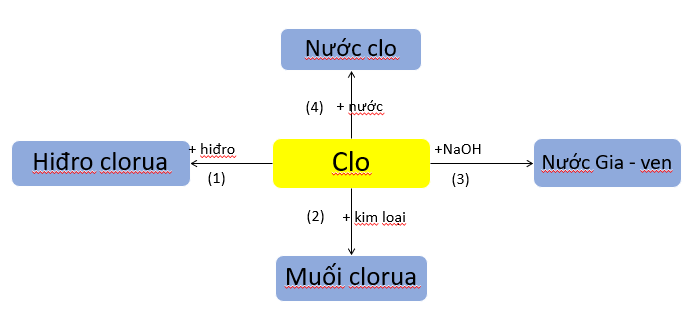
a) Tính chất hóa học của clo
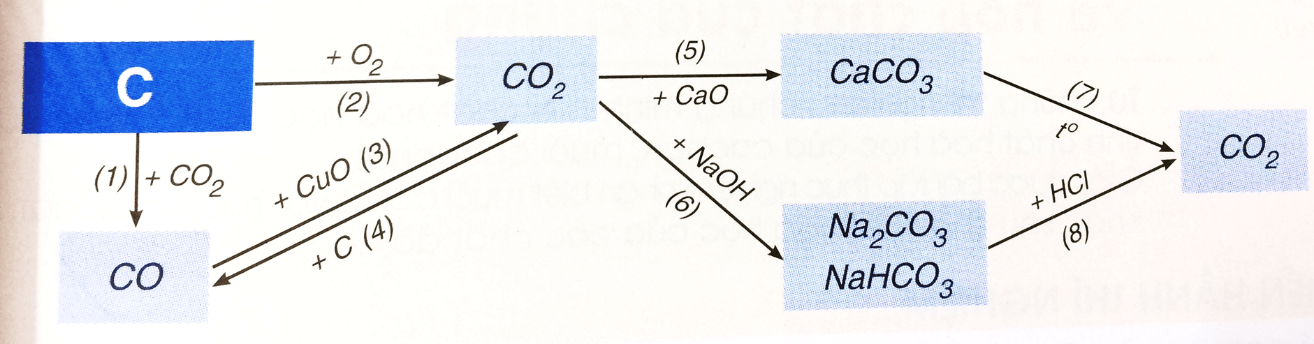
b) Tính chất hóa học các hợp chất của cacbon
3. Bảng tuần hoàn các nguyên tố hóa học
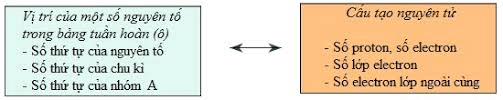
a) Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b) Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+) Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
+) Số lớp electron của nguyên tử tăng dần.
+) Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
c) Ý nghĩa bảng tuần hoàn
Biết vị trí của nguyên tố trong bảng tuần hoàn ta có thể suy đoán cấu tạo nguyên tử và ngược lại.

B. Bài tập trắc nghiệm
Câu 1: Nguyên tố X có hiệu số nguyên tử là 9. Điều khẳng định nào sau đây không đúng ?
A. Điện tích hạt nhân của nguyên tử là 9+, nguyên tử có 9 electron.
B. Nguyên tử X ở gần cuối chu kỳ 2, đầu nhóm VII.
C. X là 1 phi kim hoạt động mạnh.
D. X là 1 kim loại hoạt động yếu.
Đáp án
Đáp án: D
Câu 2: Cặp chất tác dụng được với dung dịch KOH là
A. CO, SO2
B. SO2, SO3
C. FeO, Fe2O3
D. NO, NO2
Đáp án
Đáp án: B
SO2 và SO3 là các oxit axit nên tác dụng được với dung dịch KOH
Phương trình hóa học:
SO2 + 2KOH → K2SO3 + H2O
SO3 + 2KOH → K2SO4 + H2O
Câu 3: Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu ?
A. CO
B. CO2
C. SO2
D. NO
Đáp án
Đáp án: A
A. quỳ tím hóa đỏ.
B. quỳ tím hóa xanh.
C. quỳ tím không chuyển màu.
D. quỳ tím hóa đỏ sau đó mất màu ngay.
Đáp án
Đáp án: D
Câu 5: Phản ứng giữa Cl2 và dung dịch NaOH ở điều kiện thường dùng để điều chế
A. thuốc tím.
B. nước gia - ven.
C. clorua vôi.
D. kali clorat.
Đáp án
Đáp án: B
Câu 6: Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại ?
A. Al2O3
B. K2O
C. CaO
D. Fe3O4
Đáp án
Đáp án: D
Cacbon khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học
Câu 7: Trong các chất sau chất nào có thể tham gia phản ứng với clo ?
A. Oxi.
B. Dung dịch KOH.
C. CuO.
D. NaCl.
Đáp án
Đáp án: B
Cl2 + 2KOH → KCl + KClO + H2O
Câu 8: Khí CO lẫn tạp chất là CO2 và SO2 có thể làm sạch CO bằng cách dẫn mẫu khí trên qua
A. dung dịch H2SO4 đặc.
B. dung dịch Ca(OH)2.
C. dung dịch CaSO4.
D. dung dịch CaCl2.
Đáp án
Đáp án: B
Dẫn hỗn hợp khí qua dung dịch Ca(OH)2 dư. Khí SO2 và CO2 phản ứng bị giữ lại, khí CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Câu 9: Đốt cháy hoàn toàn 3 gam C thành CO2. Cho toàn bộ sản phẩm hấp thụ vào dung dịch nước vôi trong dư. Khối lượng kết tủa tạo thành là
A. 50 gam.
B. 25 gam.
C. 15 gam.
D. 40 gam.
Đáp án
Đáp án: B
Ta có: nC = 3 : 12 = 0,25 mol
Khối lượng kết tủa: m = 0,25.100 = 25 gam.
A. 4,48 lít.
B. 6,72 lít.
C. 17,92 lít.
D. 13,44 lít.
Đáp án
Đáp án: C
Câu 11: Thể tích của dung dịch KOH 1M ở điều kiện thường cần dùng để tác dụng hoàn toàn với 1,12 lít khí Cl2 (đktc) là
A. 0,2 lít.
B. 0,3 lít.
C. 0,4 lít.
D. 0,1 lít.
Đáp án
Đáp án: D
Câu 12: Một nguyên tố X ở ô thứ 12 trong bảng tuần hoàn. Điện tích hạt nhân nguyên tử X là
A. 12-.
B. 12+.
C. -12.
D. +12.
Đáp án
Đáp án: B
Câu 13: Số thứ tự ô nguyên tố trong bảng hệ thống tuần hoàn bằng:
A. số hiệu nguyên tử
B. nguyên tử khối
C. số nơtron
D. số lớp electron.
Đáp án
Đáp án: A.
Câu 14: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là
A. 3 và 3
B. 4 và 3
C. 3 và 4
D. 4 và 4
Đáp án
Đáp án: C
Câu 15: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. tính kim loại tăng dần.
B. tính phi kim tăng dần.
C. tính kim loại không đổi.
D. tính phi kim giảm dần.
Hiển thị đáp án
Đáp án: B