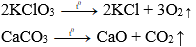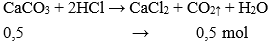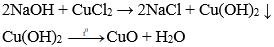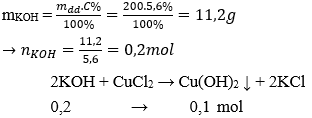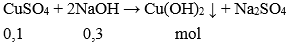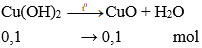Hoá học lớp 9 Bài 9: Tính chất hóa học của muối
Lý thuyết tổng hợp Hoá học lớp 9 Bài 9: Tính chất hóa học của muối chọn lọc năm 2021 – 2022 mới nhất gồm tóm tắt lý thuyết và hơn 500 bài tập ôn luyện Hoá 9. Hy vọng bộ tổng hợp lý thuyết Hoá học 9 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hoá lớp 9.
Bài 9: Tính chất hóa học của muối
A. Lý thuyết
I. Tính chất hóa học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tác dụng với axit
Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ:
AgNO3 + HCl → AgCl ↓ + HNO3
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với dung dịch muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
AgNO3 + NaCl → NaNO3 + AgCl↓
BaCl2 + K2SO4 → 2KCl + BaSO4 ↓
Dung dịch muối có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ:
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
5. Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
II. Phản ứng trao đổi trong dung dịch
1. Định nghĩa: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không xảy ra.
Ví dụ:
HCl + NaOH → NaCl + H2O

B. Bài tập trắc nghiệm
Câu 1: Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra ?
A. Khí hiđro
B. Khí oxi
C. Khí lưu huỳnh đioxit
D. Khí hiđro sunfua
Đáp án: C
Na2SO3 + H2SO4 → Na2SO4 v+ SO2↑ + H2O
Câu 2: Cho 50 g CaCO3 vào dung dịch HCl dư thể tích CO2 thu được ở đktc là:
A. 11,2 lít
B. 1,12 lít
C. 2,24 lít
D. 22,4 lít
Đáp án: A
Số mol CaCO3 = 50 : 100 = 0,5 mol
→ Vkhí = n.22,4 = 0,5.22,4 = 11,2 lít.
Câu 3: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Đáp án: C
3KOH + FeCl3 → 3KCl + Fe(OH)3 (↓ đỏ nâu)
Câu 4: Hãy cho biết muối nào có thể điều chế bằng phản ứng của kim loại với dung dịch axit H2SO4 loãng ?
A. ZnSO4
B. Na2SO3
C. CuSO4
D. MgSO3
Đáp án: A
Zn + H2SO4 (loãng) → ZnSO4 + H2
Câu 5: Cặp chất nào sau đây không thể tồn tại trong 1 dung dịch (do có phản ứng với nhau) ?
A. NaOH, MgSO4
B. KCl, Na2SO4
C. CaCl2, NaNO3
D. ZnSO4, H2SO4
Đáp án: A
2NaOH + MgSO4 → Mg(OH)2 ↓ + Na2SO4
Câu 6: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được 2 dung dịch muối trong mỗi cặp chất sau:
A. Na2SO4 và Fe2(SO4)3
B. Na2SO4 và K2SO4
C. Na2SO4 và BaCl2
D. Na2CO3 và K3PO4
Đáp án: A
Sử dụng NaOH có thể phân biệt được cặp Na2SO4 và Fe2(SO4)3
+ Nếu không có hiện tượng gì → Na2SO4
+ Nếu xuất hiện kết tủa đỏ nâu → Fe2(SO4)3
6NaOH + Fe2(SO4)3 → 2Fe(OH)3 (↓ đỏ nâu) + 3Na2SO4.
A. Cu
B. CuO
C. Cu2O
D. Cu(OH)2.
Đáp án: B
Câu 8: Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư, sau phản ứng thu được lượng chất kết tủa là:
A. 19,6 g
B. 9,8 g
C. 4,9 g
D. 17,4 g
Đáp án: B
→ Khối lượng kết tủa: m↓ = 0,1. (64 + 17.2) = 9,8 gam.
Câu 9: Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 8 g
B. 4 g
C. 6 g
D. 12 g
Đáp án: A
Theo PTHH có NaOH dư → số mol Cu(OH)2 tính theo số mol CuSO4
→ m = 0,1.80 = 8 gam.
A. BaCl2, Na2SO4
B. Na2CO3, Ba(OH)2
C. BaCl2, AgNO3
D. NaCl, K2SO4
Đáp án: D