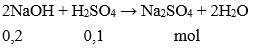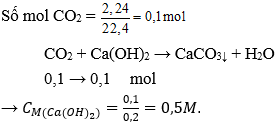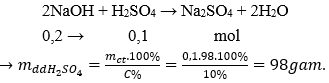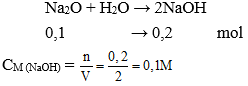Hoá học lớp 9 Bài 8: Một số bazơ quan trọng
Lý thuyết tổng hợp Hoá học lớp 9 Bài 8: Một số bazơ quan trọng chọn lọc năm 2021 – 2022 mới nhất gồm tóm tắt lý thuyết và hơn 500 bài tập ôn luyện Hoá 9. Hy vọng bộ tổng hợp lý thuyết Hoá học 9 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hoá lớp 9.
Bài 8: Một số bazơ quan trọng
A. Lý thuyết
I. NATRI HIĐROXIT (công thức hóa học NaOH)
1. Tính chất vật lí
- Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn, làm bục vải giấy và ăn mòn da. Khi sử dụng NaOH phải hết sức cẩn thận!
2. Tính chất hóa học
Natri hiđroxit có đầy đủ tính chất của một bazơ tan (kiềm).
a. Làm đổi màu chất chỉ thị.
Dung dịch NaOH làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b. Tác dụng với axit tạo thành muối và nước (phản ứng trung hòa)
Ví dụ:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
c. Tác dụng với oxit axit tạo thành muối và nước
Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
CO2 dư + Na2CO3 + H2O → 2NaHCO3
SO2 dư + Na2SO3 + H2O → 2NaHSO3
d. Tác dụng với dung dịch muối.
Dung dịch NaOH có thể tác dụng được với nhiều dung dịch muối.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
3. Ứng dụng
Natri hiđroxit có nhiều ứng dụng trong đời sống và trong công nghiệp. Nó được dùng trong:
- Sản xuất xà phòng, chất tẩy rửa, bột giặt.
- Sản xuất giấy, tơ nhân tạo, trong chế biến dầu mỏ.
- Sản xuất nhôm (làm sạch quặng nhôm trước khi sản xuất).
- Chế biến dầu mỏ và nhiều ngành công nghiệp hóa chất khác.
4. Sản xuất natri hiđroxit
Trong công nghiệp, NaOH được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa. Thùng điện phân có màng ngăn giữa cực âm và cực dương.
Dung dịch canxi hiđroxit có tên thông thường là nước vôi trong.
1. Tính chất hóa học Ca(OH)2
Dung dịch Ca(OH)2 có tính chất hóa học của một bazơ tan.
a) Làm đổi màu chất chỉ thị
Dung dịch Ca(OH)2 làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b) Tác dụng với axit
Ca(OH)2 tác dụng với axit, sản phẩm là muối và nước (phản ứng trung hòa)
Ví dụ:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + H2O
c) Tác dụng với oxit axit
Dung dịch Ca(OH)2 tác dụng với oxit axit sản phẩm là muối và nước
Ví dụ:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Chú ý: Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư + CaCO3 + H2O → Ca(HCO3)2
SO2 dư + CaSO3 + H2O → Ca(HSO3)2
Ngoài ra dung dịch canxi hiđroxit còn tác dụng được với nhiều dung dịch muối.
Canxi hiđroxit có nhiều ứng dụng. Nó được dùng để:
- Làm vật liệu trong xây dựng.
- Khử chua đất trồng trọt.
- Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật…
III. Thang PH
Thang pH để biểu thị độ axit, độ bazơ của dung dịch:
- Nếu pH = 7: Dung dịch là trung tính.
Ví dụ: nước cất có pH = 7.
- Nếu pH < 7: Dung dịch có tính axit. pH càng nhỏ độ axit của dung dịch càng lớn.
- Nếu pH > 7: Dung dịch có tính bazơ, pH càng lớn độ bazơ của dung dịch càng lớn.

B. Bài tập trắc nghiệm
Câu 1: Thuốc thử để nhận biết dung dịch Ca(OH)2 là
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Đáp án: A.
Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Câu 2: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Đáp án: C.
Các dung dịch bazơ (NaOH; Ca(OH)2…) có pH > 7.
Câu 3: Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
A. Làm quỳ tím chuyển đỏ
B. Làm quỳ tím chuyển xanh
C. Làm dung dịch phenolphtalein không màu chuyển đỏ.
D. Không làm thay đổi màu quỳ tím.
Đáp án: D
nNaOH = 0,2.1 = 0,2 mol; số mol H2SO4 = 0,1.1 = 0,1 mol
Theo PTHH, sau phản ứng NaOH và H2SO4 đều hết, dung dịch thu được Na2SO4 không làm đổi màu quỳ tím.
Câu 4: Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
A. Fe(OH)3, BaCl2, CuO, HNO3.
B. H2SO4, SO2, CO2, FeCl2
C. HNO3, HCl, CuSO4, KNO3
D. Al, MgO, H3PO4, BaCl2
Đáp án: B
Câu 5: Dung dịch Ca(OH)2 phản ứng với tất cả các chất trong dãy chất nào sau đây?
A. NaCl, HCl, Na2CO3, KOH
B. H2SO4, NaCl, KNO3, CO2
C. KNO3, HCl, KOH, H2SO4
D. HCl, CO2, Na2CO3, H2SO4
Đáp án: D
Câu 6: Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl
B. Nước vôi trong
C. Dung dịch HCl
D. Dung dịch NaNO3
Đáp án: B
A. CO2, Na2O.
B. CO2, SO2.
C. SO2, K2O
D. SO2, BaO.
Đáp án: B.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Câu 8: Cho 2,24 lít khí CO2 ( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2 chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
Đáp án: A
Câu 9: Trung hòa 200 ml dung dịch NaOH 1M bằng dung dịch H2SO4 10%. Khối lượng dung dịch H2SO4 cần dùng là:
A. 98 g
B. 89 g
C. 9,8 g
D. 8,9 g
Đáp án: A
nNaOH = 0,2.1 = 0,2 mol
A. 0,1M
B. 0,2 M
C. 0,3M
D. 0,4M
Đáp án: A
Số mol Na2O = 6,2 : 62 = 0,1 mol