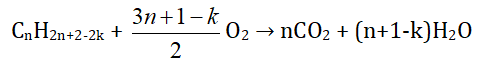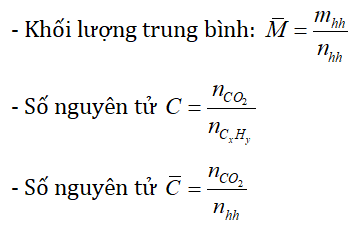Cách giải Bài toán đốt cháy hợp chất hữu cơ hay, chi tiết
Cách giải Bài toán đốt cháy hợp chất hữu cơ hay, chi tiết Hóa học lớp 9 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải Bài toán đốt cháy hợp chất hữu cơ hay, chi tiết.
Cách giải Bài toán đốt cháy hợp chất hữu cơ hay, chi tiết
Lý thuyết và Phương pháp giải
Hidrocacbon CxHy hoặc CnH2n+2-2k (n ≥ 1, 𝑘 ≥ 0)
* Dựa vào sản phẩm của phản ứng đốt cháy hidrocacbon:
- nH2O > nCO2 ⇒ CTPT CnH2n+2 và nCnH2n+2 = nH2O - nCO2
- nH2O = nCO2 ⇒ CTPT CnH2n
- nH2O < nCO2 ⇒ CTPT CnH2n-2 và nCnH2n-2 = nCO2 - nH2O
* Thường áp dụng ĐLBT nguyên tố và bảo toàn khối lượng:
BTKL: mCxHy + mO2 pư = mCO2 + mH2O
BTNT:
nC(CxHy) = nC(CO2)
nH(CxHy) = nH(H2O)
⇒ mCxHy pư = mC + mH = 12.nCO2 + 2. nH2O
nO2 pư = nCO2 + 1/2 nH2O
* Một số công thức cần nhớ:
Chú ý:
- Nếu cho sản phẩm cháy thu được dẫn qua bình (1) đựng chất hấp thụ H2O: P2O5, H2SO4 đặc, CaCl2…bình (2) đựng chất hấp thụ CO2 như: NaOH, KOH, Ca(OH)2, Ba(OH)2…
Khi đó:
Khối lượng bình (1) tăng = mH2O
Khối lượng bình (2) tăng = mCO2
- Nếu cho toàn bộ sản phẩm cháy qua dung dịch Ca(OH)2, Ba(OH)2 thì khối lượng bình tăng = mCO2 +mH2O. Khi đó khối lượng dung dịch tăng hoặc giảm so với khối lượng dung dịch ban đầu.
+ Khối lượng dung dịch tăng: Δ𝑚𝑑𝑑 ↑ = (mCO2+mH2O) - m↓
+ Khối lượng dung dịch giảm: Δ𝑚𝑑𝑑 ↓ = m↓ -( mCO2+mH2O)

Bài tập vận dụng
Bài 1: Đốt cháy hoàn toàn 0,15 mol hỗn hợp A gồm 2 hidrocacbon no thu được 9,45g H2O. Cho sản phẩm cháy vào dung dịch Ca(OH)2 dư thì khối lượng kết tủa thu được là bao nhiêu?
Hướng dẫn:
nH2O = 9,45/18 = 0,525 mol
nA = nH2O – nCO2 ⇒ nCO2 = nH2O – nA =0,525-0,15 = 0,375 mol
nCaCO3 = nCO2 = 0,375 mol
⇒ mCaCO3 = 0,375.100 = 37,5g
Bài 2: Khi đốt hoàn toàn 3 gam một hợp chất hữu cơ A thu được 8,8 gam CO2 và 5,4 gam H2O
a) Trong A có chứa những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Xác định công thức phân tử của A?
c) A có làm mất màu dung dịch brom không?
Hướng dẫn:
a)
→ mO = 3 – (mC + mH) = 3 – 2,4 – 0,6 = 0
→ A chỉ chứa 2 nguyên tố C và H
b)
nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A: (CH3)n
MA < 40 → 15n < 40 → n < 2,67 → n chỉ có thể là 1 hoặc 2
TH 1: n = 1 → Công thức phân tử của A là CH3 ( Loại)
TH 2: n = 2 → Công thức phân tử của A là C2H6 ( thỏa mãn)
c) C2H6 không làm mất màu dung dịch brom