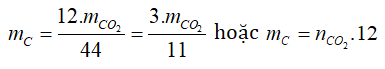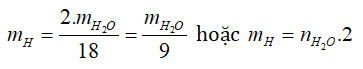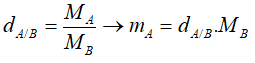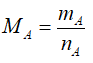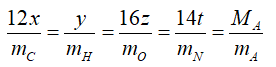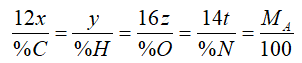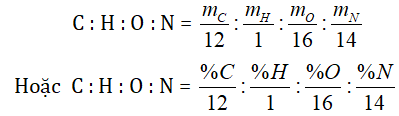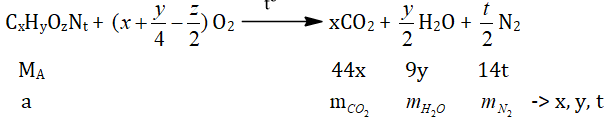Cách lập công thức phân tử hợp chất hữu cơ hay, chi tiết
Cách lập công thức phân tử hợp chất hữu cơ hay, chi tiết Hóa học lớp 9 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách lập công thức phân tử hợp chất hữu cơ hay, chi tiết.
Cách lập công thức phân tử hợp chất hữu cơ hay, chi tiết
Lý thuyết và Phương pháp giải
Để giải dạng bài tìm công thức phân tử hợp chất hữu cơ này, đầu tiên ta cần xác định hợp chất hữu cơ cần tìm có những nguyên tố gì, sau đó tùy theo đề bài để giải bài toán.
Giả thiết bài toán:
Đốt cháy a (gam) hợp chất hữu cơ A thu được m (g) CO2, m (g) H2O và m (g) N2 (nếu có). Tính M khối lượng mol của A (mA) yêu cầu lập công thức phân tử của A.
Các bước lập công thức phân tử:
Bước 1: Định lượng các nguyên tố trong A.
- Tìm C: Dựa vào CO2
- Tìm H: Dựa vào H2O.
- Tìm N: Dựa vào N2.
mN = mN2 hoặc mN = nN2.28
- Tìm O: Dùng phương pháp loại suy.
mO = a - (mC + mH + mN)
Bước 2: Tính khối lượng phân tử gần đúng của hợp chất hữu cơ.
- Dựa vào tỉ khối hơi:
Nếu B là không khí thì MB = 29.
- Dựa vào số mol và khối lượng:
Bước 3: Lập công thức phân tử của A.
- Ở bước này, ta có 3 cách để lập công thức phân tử của A.
● Cách 1: Dựa vào thành phần khối lượng của các nguyên tố trong phân tử hợp chất hữu cơ. Đối với cách này thường phổ biến đối với bài toán cơ bản cho trước MA.
Ta có công thức tổng quát CxHyOzNt.
Hoặc nếu bài toán cho phần trăm khối lượng của các %C ta có công thức:
Thay các giá trị đã biết vào công tác thức trên suy ra các giá trị x, y, z, t, sau đó thay vào CTTQ ta được công thức phân tử cần lập.
● Cách 2: Lập công thức phân tử qua công thức thực nghiệm. Đối với cách này thường dùng để giải các bài toán mà yêu cầu lập công thức nguyên hay bài toán cho thiếu giả thiết để tính MA.
Trước tiên ta lập tỷ lệ số nguyên tử giữa các nguyên tố
= a : b : c : d (là tỉ lệ số nguyên, tối giản)
Suy ra công thức thực nghiệm (CaHbOcNd)n.
Trong đó n ≥ 1 (là số nguyên): gọi là hệ số thực nghiệm.
Dựa vào MA hoặc giả thiết của đề cho suy ra n, thay vào công thức thực nghiệm suy ra công thức phân tử cần lập.
● Cách 3: Dựa vào phương trình cháy.
Giáo viên hướng dẫn cho học sinh phương trình cháy tổng quát nhất và cách điền số vào phương trình.
Sau đó dựa vào MA = 12x + y + 16z + 14t → Z

Bài tập vận dụng
Bài 1: Khi đốt hoàn toàn 3 gam một hợp chất hữu cơ A thu được 8,8 gam CO2 và 5,4 gam H2O
a) Trong A có chứa những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Xác định công thức phân tử của A?
c) A có làm mất màu dung dịch brom không?
Hướng dẫn:
Giải tương tự bài 2, nhưng ở bước 4 tìm công thức đơn giản nhất phải biện luận vì đề bài cho phân tử khối của A < 40
a)
nCO2 = 8,8/44 = 0,2 mol → nC = 0,2 mol → mC = 0,2.12 = 2,4g
nH2O = 5,4/18 = 0,3 mol → nH = 0,3.2 = 0,6 mol → mH = 0,6.1 = 0,6g
→ mO = 3 – (mC + mH) = 3 – 2,4 – 0,6 = 0
→ A chỉ chứa 2 nguyên tố C và H
b)
nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A: (CH3)n
MA < 40 → 15n < 40 → n < 2,67 → n chỉ có thể là 1 hoặc 2
TH 1: n = 1 → Công thức phân tử của A là CH3 ( Loại)
TH 2: n = 2 → Công thức phân tử của A là C2H6 ( thỏa mãn)
c) C2H6 không làm mất màu dung dịch brom
Bài 2: Phân tử hợp chất hữu cơ A có 2 nguyên tố. Đốt cháy hoàn toàn 3 gam chất A thu được 5,4 gam nước. Hãy xác định công thức phân tử của A. Biết khối lượng mol của A là 30 gam.
Hướng dẫn:
Cách 1
Hợp chất hữu có A có 2 nguyên tố, khi đốt cháy thu được nước
→ A chứa 2 nguyên tố C và H
nH2O = 5,4/18 = 0,3 mol
→ nH = 2. 0,3 = 0,6 mol → mH = 0,6 gam
→ mC = 3 - 0,6 = 2,4 gam → nC = 2,4/12= 0,2 mol
→ nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A là (CH3)n
Mà MA = 30 → 15n = 30 → n = 2
→ CTPT của A là C2H6
Cách 2
A là chất hữu cơ nên trong A phải chứa nguyên tố C.
Khi đốt cháy A thu được nước → trong A phải có H
Mặt khác A chứa 2 nguyên tố nên A có công thức CxHy
nA = 3/30 = 0,1 ml; nH2O = 5,4/18 = 0,3 mol
4 CxHy + O2 → 4x CO2 + 2y H2O
4.…………………………………2y
0,1………………………………0,3
→ 0,1.2y = 4.0,3 → y = 6
Mặt khác 12x+y = 30 → 12x + 6 = 30 → x = 2
→ CTPT của A là: C2H6
Bài 3: Đốt cháy 3 gam một chất hữu cơ A thu được 6,6 gam CO2 và 3,6 gam H2O. Xác định công thức phân tử của A, biết khối lượng mol phân tử của A là 60 gam
Hướng dẫn:
nCO2 = 6,6/44=0,15 mol; nH2O = 3,6/18 = 0,2 mol
→ nC = 0,15 mol; nH = 0,2.2 = 0,4 mol→ mC = 12.0,15 = 1,8 gam; mH = 0,4.1 = 0,4 gam
→ mC + mH = 1,8 + 0,4 = 2,2 gam < mA
→ Trong A còn có O (vì khi đốt cháy chỉ thu được CO2 và H2O)
→ mO = 3 – (mC + mH) = 3 – 2,2 = 0,8 mol → nO = 0,8/16 = 0,05 mol
→ nC : nH : nO = 0,15 : 0,4 : 0,05 = 3 : 8 :1
→ Công thức đơn giản nhất của A là (C3H8O)n
MA = 60 → 60n = 60 → n = 1
→ CTPT của A là C3H8O