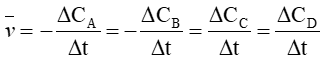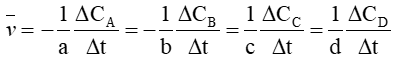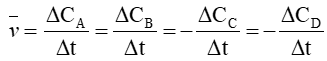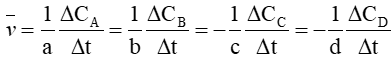Trắc nghiệm Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bộ 15 bài tập trắc nghiệm Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng có đáp án đầy đủ gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hóa 10 Bài 15.
Trắc nghiệm Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng - Chân trời sáng tạo
Câu 1. Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2 (g) ⟶ 2HCl (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần.
A. tăng 4 lần;
B. giảm 4 lần;
C. giảm 2 lần;
D. tăng 8 lần.
Đáp án: D
Giải thích:
Theo định luật tác dụng khối lượng, tốc độ tức thời của phản ứng là: =
Nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần, ta có:
= = =
Vậy tốc độ phản ứng giảm 2 lần.
Câu 2. Biểu thức tốc độ trung bình của phản ứng: aA + bB ⟶ cC + dD là
A.
B.
C.
D.
Đáp án: B
Giải thích:
Biểu thức tốc độ trung bình của phản ứng: aA + bB ⟶ cC + dD là
Trong đó:
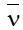
là sự biến thiên nồng độ.
là biến thiên thời gian.
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1, t2.
Câu 3. Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
A. 1463 M / giây;
B. 6,8.10−4 M / giây;
C. 8,6.10−4 M / giây;
D. 6,8.104 M / giây.
Đáp án: B
Giải thích:
Vì O2 là sản phẩm nên nồng độ tại thời điểm ban đầu của O2 bằng 0, do đó: (M)
Theo bài ta có:
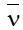
Câu 4. Tốc độ phản ứng của một phản ứng hóa học là
A. đại lượng đặc trưng cho sự biến thiên nồng độ của chất phản ứng trong một đơn vị thời gian;
B. đại lượng đặc trưng cho sự biến thiên nồng độ của chất sản phẩm trong một đơn vị thời gian;
C. đại lượng đặc trưng cho sự biến thiên tốc độ chuyển động của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian;
D. đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Đáp án: D
Giải thích:
Câu 5. Cho phản ứng:
2N2O5 (g) ⟶ O2 (g) + 4NO2 (g)
Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5 giảm từ 0,4 M về 0,35 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
A. 8,48.10−4 M / giây;
B. 4,42.10−4 M / giây;
C. 8,84.10−4 M / giây;
D. 4,24.10−4 M / giây.
Đáp án: D
Giải thích:
Tốc độ trung bình của phản ứng trong khoảng thời gian từ giây 57 đến giây 116 là:
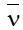
Câu 6. Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
A. =
B. =
C. =
D. =
Đáp án: A
Giải thích:
Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Theo định luật tác dụng khối lượng, mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức =
Trong đó, k là hằng số tốc độ phản ứng; CA, CB là nồng độ (M) chất A, chất B tại thời điểm đang xét.
Câu 7. Cho phản ứng: 2SO2 (g) + O2 (g) 2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là
A. =
B. =
C. =
D. =
Đáp án: A
Giải thích:
Phản ứng: 2SO2 (g) + O2 (g) 2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là:
=
Câu 8. Hằng số tốc độ phản ứng k chỉ phụ thuộc vào
A. bản chất của phản ứng;
B. nồng độ các chất;
C. nhiệt độ;
D. Cả A và C.
Đáp án: D
Giải thích:
Câu 9. Hằng số tốc độ phản ứng k bằng vận tốc tức thời khi
A. nồng độ chất phản ứng bằng đơn vị (1 M);
B. nhiệt độ ở 0°C;
C. nhiệt độ ở 25°C;
D. hằng số tốc độ phản ứng k không thể bằng vận tốc tức thời .
Đáp án: A
Giải thích:
Câu 10. Cho phản ứng đơn giản xảy ra trong bình kín: 2CO (g) + O2 (g) ⟶ 2CO2 (g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2 không đổi.
A. tăng gấp 4 lần
B. tăng gấp 8 lần
C. không thay đổi
D. giảm 2 lần
Đáp án: A
Giải thích:
Theo định luật tác dụng khối lượng, tốc độ tức thời của phản ứng là: =
Nếu tăng nồng độ CO gấp 2 lần, ta có: =
Vậy tốc độ phản ứng tăng gấp 4 lần.
Câu 11. Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 3 lần.
A. tăng 3 lần;
B. tăng 6 lần;
C. tăng 9 lần;
D. tăng 81 lần.
Đáp án: D
Giải thích:
Theo định luật tác dụng khối lượng, tốc độ tức thời của phản ứng là: =
Nếu nồng độ H2 và N2 đều tăng lên 3 lần, ta có:
=
= 81
Vậy tốc độ phản ứng tăng 81 lần.
Câu 12. Kí hiệu và đơn vị của tốc độ phản ứng là
A. kí hiệu là , đơn vị là (đơn vị nồng độ) / đơn vị thời gian;
B. kí hiệu là 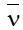
C. kí hiệu là , đơn vị là (đơn vị nồng độ) / đơn vị thể tích;
D. kí hiệu là 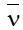
Đáp án: A
Giải thích:
Câu 13. Cho phản ứng: Br2 (l) + HCOOH (aq)⟶ 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là
A. 0,02 M;
B. 0,07 M;
C. 0,02 M;
D. 0,022 M.
Đáp án: D
Giải thích:
Áp dụng công thức tính tốc độ trung bình của phản ứng, ta có:
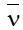
Do đó 4.10-5 = ⇒ a = 0,022 (M)
Câu 14. Cho phản ứng: 2H2O2 (aq)O2 (s) +2H2O (l)
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10−4 M/s;
B. 5.10−4 M/s;
C. 1,5.10−4 M/s;
D. 3.10−4 M/s.
Đáp án: A
Giải thích:
Ta có: = = 1,5.10−3 (mol)
Theo phương trình: phản ứng = 2= 2. 1,5.10−3 = 3.10−3 (mol)
phản ứng = = 0,03 (M)
Mà phản ứng = (bđ) − (sau 60 giây) =
Do đó: = − 0,03 (M)
Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
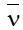
Câu 15. Hiện tượng nào dưới đây xảy ra với tốc độ nhanh nhất?
A. Nướng bánh;
B. Lên men sữa chua tạo sữa chua;
C. Đốt gas khi nấu ăn;
D. Cánh cổng sắt bị gỉ sét.
Đáp án: C
Giải thích:
Các câu hỏi trắc nghiệm Hóa 10 sách Chân trời sáng tạo có đáp án, chọn lọc khác: