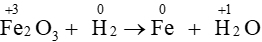Trắc nghiệm Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bộ 15 bài tập trắc nghiệm Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống có đáp án đầy đủ gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hóa 10 Bài 12.
Trắc nghiệm Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống - Chân trời sáng tạo
Câu 1. Cho phản ứng: 3Cu + 8H+ + 2NO3−⟶3Cu2+ + 2NO + 4H2O
Quá trình khử là
A. ;
B. ;
C. ⟶+ 3e;
D. ⟶+ 2e.
Đáp án: A
Giải thích:
Quá trình khử là quá trình chất oxi hóa nhận electron.
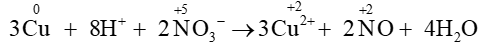
Vậy quá trình khử trong phản ứng: 3Cu + 8H+ + 2NO3−⟶3Cu2+ + 2NO + 4H2O là
+ 3e ⟶
Câu 2. Số oxi hóa của các nguyên tử trong H2, Fe2+, Cl- lần lượt là
A. 0; −2; +1;
B. +2; −2; +1;
C. 0; +2; −1;
D. +1; +2; −1.
Đáp án: C
Giải thích:
Ta có: số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0. Do đó số oxi hóa của H trong H2 là 0.
Trong ion, số oxi hóa của nguyên tử bằng điện tích của ion. Do đó:
Fe2+ có điện tích là 2+ nên Fe có số oxi hóa là +2.
Cl− có điện tích là 1− nên Cl có số oxi hóa là −1.
Câu 3. Phát biểu nào sau đây sai khi nói về số oxi hóa trong hợp chất?
A. Số oxi hóa của H là +1 (trừ một số hydride kim loại NaH, CaH2, …);
B. Số oxi hóa của O luôn là –2;
C. Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, …) luôn là +1, của kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, …) luôn là +2;
D. Số oxi hóa của Al luôn là +3, của F luôn là –1.
Đáp án: B
Giải thích:
Trong hợp chất, số oxi hóa của O thường là –2 (trừ một số trường hợp như OF2, H2O2, …)
Vậy phát biểu B là sai.
Câu 4. Số oxi hóa của một nguyên tử trong phân tử được định nghĩa là
A. điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn;
B. hóa trị của nguyên tử nguyên tố đó;
C. điện tích thực của nguyên tử nguyên tố đó;
D. độ âm điện của nguyên tử nguyên tố đó.
Đáp án: A
Giải thích:
Câu 5. Số oxi hóa của Mn trong các phân tử MnO2, KMnO4, K2MnO4 lần lượt là
A. +2, +4, +3;
B. −4, +7, +6;
C. +4, +7, +6;
D. +2, +5, +6.
Đáp án: C
Giải thích:
Gọi số oxi hóa của nguyên tử Mn là x, theo quy tắc 1 và 2 về xác định số oxi hóa, ta có:
Trong phân tử MnO2: ⇒ x = +4
Trong phân tử KMnO4: ⇒ x = +7
Trong phân tử K2MnO4: ⇒ x = +6.
Câu 6. Số oxi hóa của nguyên tử N trong các ion NH4+, NO3−, NO2− lần lượt là
A. −3, +5, +3
B. −3, +3, + 5
C. +5, −2, +3
D. +5, +3, +2
Đáp án: A
Giải thích:
Gọi số oxi hóa của nguyên tử N là x, theo quy tắc 1 và 2 về xác định số oxi hóa, ta có:
Trong ion NH4+: ⇒ x = −3
Trong ion NO3−: ⇒ x = +5
Trong ion NO2−: ⇒ x = +3
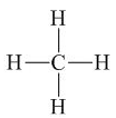
Câu 7. Cho phân tử CH4 công thức cấu tạo dưới đây. Số oxi hóa của C là
A. −4;
B. −2;
C. +4;
D. +2.
Đáp án: A
Giải thích:
Trong mỗi liên kết C−H, H góp 1 electron, khi giả định CH4 là hợp chất ion thì electron này chuyển sang C.
Vì có 4 liên kết C −H nên số oxi hóa của C là −4.
Câu 8. Phát biểu sai là
A. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử;
B. Phản ứng oxi hóa – khử có thể chỉ có quá trình oxi hóa hoặc quá trình khử;
C. Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron;
D. Quá trình khử (sự khử) là quá trình nhận electron.
Đáp án: B
Giải thích:
Câu 9. Chất khử là chất
A. nhận electron, có số oxi hóa tăng, bị oxi hóa
B. nhận electron, có số oxi hóa giảm, bị khử
C. nhường electron, có số oxi hóa tăng, bị oxi hóa
D. nhường electron, có số oxi hóa giảm, bị khử
Đáp án: C
Giải thích:
Chất khử là chất nhường electron, có số oxi hóa tăng, bị oxi hóa.
Chất oxi hóa là chất nhận electron, có số oxi hóa giảm, bị khử.
Câu 10. Phản ứng nào dưới đây là phản ứng oxi hóa – khử?
A. SO3 + H2O ⟶H2SO4
B. CaCO3CaO + CO2 ↑
C. H2SO4 + Ba(OH)2 ⟶ BaSO4 ↓ + 2H2O
D. Mg + 2HCl ⟶ MgCl2 + H2 ↑
Đáp án: D
Giải thích:
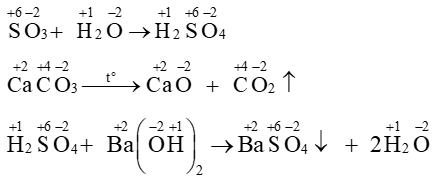
Trong phản ứng không có nguyên tố nào thay đổi số oxi hóa ⇒ không phải phản ứng oxi hóa – khử.
Mg có số oxi hóa tăng từ 0 lên +2; H có số oxi hóa giảm từ +1 về 0. ⇒ Trong phản ứng có 2 nguyên tố thay đổi số oxi hóa. ⇒ Đây là phản ứng oxi hóa – khử.
Câu 11. Cho phản ứng: Fe + CuSO4 ⟶ Cu + FeSO4.
Khẳng định đúng là
A. Chất khử là Cu2+, chất oxi hóa là Fe;
B. Chất khử là Fe, chất oxi hóa là Cu2+;
C. Chất khử là Cu, chất oxi hóa là Fe2+;
D. Chất khử là Fe2+, chất oxi hóa là Cu.
Đáp án: B
Giải thích:
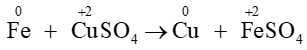
Cu2+ (CuSO4) có số oxi hóa giảm sau phản ứng ⇒ Cu2+ đã nhận electron ⇒ Chất oxi hóa là Cu2+
Fe có số oxi hóa tăng sau phản ứng ⇒ Fe đã nhường electron ⇒ Chất khử là Fe.
Câu 12. Cho nguyên tố X có số oxi hóa có giá trị là -2. Cách biểu diễn đúng là
A. ;
B. ;
C.
D. .
Đáp án: D
Giải thích:
Cách biểu diễn số oxi hóa:
+ Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
+ Dấu điện tích được đặt ở phía trước, số ở phía sau.
Do đó, nguyên tố X có số oxi hóa có giá trị là âm 2 được biểu diễn là:
Câu 13. Cho phản ứng: 4P + 5O2⟶ 2P2O5
Quá trình oxi hóa là
A. ⟶+ 5e;
B. + 5e ⟶;
C. + 2e ⟶;
D. ⟶+ 2e.
Đáp án: A
Giải thích:
Quá trình oxi hóa là quá trình chất khử nhường electron.
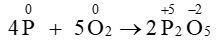
Vậy quá trình oxi hóa của phản ứng 4P + 5O2⟶ 2P2O5 là
⟶+ 5e
Câu 14. Hệ số cân bằng của H2 trong phản ứng Fe2O3 + H2⟶ Fe + H2O là
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án: C
Giải thích:
Sự thay đổi số oxi hóa của các nguyên tố:
Quá trình oxi hóa và quá trình khử:
Áp dụng nguyên tắc: tổng số electron nhường bằng tổng số electron nhận
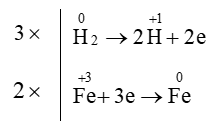
⇒Fe2O3 + 3H2⟶ 2Fe + 3H2O
Câu 15. Xác định hệ số cân bằng của HCl trong phản ứng dưới đây:
K2Cr2O7 + HCl ⟶ Cl2 + KCl + CrCl3 + H2O
A. 5;
B. 10;
C. 14;
D. 16.
Đáp án: C
Giải thích:
Sự thay đổi số oxi hóa của các nguyên tố:
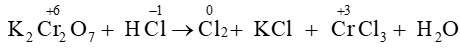
Quá trình oxi hóa và quá trình khử:
Áp dụng nguyên tắc: tổng số electron nhường bằng tổng số electron nhận
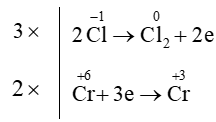
⇒ K2Cr2O7 + 14HCl ⟶3Cl2 + 2KCl + 2CrCl3 + 7H2O.
Các câu hỏi trắc nghiệm Hóa 10 sách Chân trời sáng tạo có đáp án, chọn lọc khác: