Trắc nghiệm Hóa 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bộ 15 bài tập trắc nghiệm Hóa 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử có đáp án đầy đủ gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hóa 10 Bài 4.
Trắc nghiệm Hóa 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử - Chân trời sáng tạo
Câu 1. Cho nguyên tử Fe có Z = 26. Cấu hình electron của nguyên tử Fe là
A. 1s2 2s2 2p6 3s2 3p6 3d8
B. 1s2 2s2 2p6 3s2 3p6 4d8
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d6
D. 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Đáp án: D
Giải thích:
Nguyên tử Fe có Z = 26 ⇒ có 26 electron
Phân bố 26 electron vào các AO theo thứ tự mức năng lượng tăng dần, theo nguyên lí và quy tắc phân bố electron: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Sắp xếp lại vị trí của phân lớp 4s2 và 3d6 theo quy tắc ta được cấu hình electron là:
1s2 2s2 2p6 3s2 3p6 3d6 4s2.
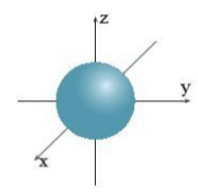
Câu 2. Hình dưới đây cho biết hình dạng của orbital
A. s;
B. p;
C. d;
D. f.
Đáp án: A
Giải thích:
Câu 3. Trong nguyên tử, các electron được sắp xếp thành từng lớp từ gần đến xa hạt nhân. Kí hiệu của các lớp thứ 1, lớp 2, lớp 3, lớp 4 lần lượt là
A. A, B, C, D;
B. V, X, Y, Z,
C. K, L, M, N
D. M, N, O, P
Đáp án: C
Giải thích:
Trong nguyên tử, các electron được sắp xếp thành từng lớp từ gần đến xa hạt nhân. Kí hiệu của các lớp thứ 1, lớp 2, lớp 3, lớp 4 lần lượt là K, L, M, N.
Câu 4. Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là
A. Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
B. Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân theo một quỹ đạo xác định, tạo thành đám mây electron.
C. Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
D. Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân, tạo thành đám mây electron.
Đáp án: C
Giải thích:
Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là:
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
Câu 5. Khẳng định nào sau đây là đúng?
A. Các electron trên cùng một lớp có năng lượng bằng nhau, trên cùng một phân lớp có năng lượng gần bằng nhau;
B. Các electron trên cùng một lớp có năng lượng gần bằng nhau, trên cùng một phân lớp có năng lượng bằng nhau;
C. Các electron trên cùng một lớp, phân lớp đều có mức năng lượng bằng nhau;
D. Các electron trên cùng một lớp, phân lớp có mức năng lượng gần bằng nhau.
Đáp án: B
Giải thích:
Khẳng định đúng là:
Các electron trên cùng một lớp có năng lượng gần bằng nhau, trên cùng một phân lớp có năng lượng bằng nhau.
Câu 6. Các phân lớp s, p, d và f lần lượt có các số AO tương ứng là
A. 1; 4; 9; 16
B. 1; 2; 3; 4
C. 1; 3; 5; 7
D. 2; 6; 10; 14
Đáp án: C
Giải thích:
Câu 7. Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng
A. 2 lần số thứ tự của lớp đó
B. số thứ tự của lớp đó
C. bình phương số thứ tự của lớp đó
D. không xác định
Đáp án: B
Giải thích:
Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
Cụ thể:
Lớp 1 có 1 phân lớp là 1s.
Lớp 2 có 2 phân lớp là 2s, 2p.
Lớp 3 có 3 phân lớp là 3s, 3p, 3d.
Lớp 4 có 4 phân lớp là 4s, 4p, 4d, 4f.
Câu 8. Theo nguyên lí Pauli
A. Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
B. Mỗi orbital chỉ chứa tối đa 1 electron.
C. Mỗi orbital chỉ chứa tối đa 2 electron và có cùng chiều tự quay.
D. Mỗi orbital chứa tối đa 3 electron.
Đáp án: A
Giải thích:
Câu 9. Số electron tối đa trong lớp thứ n (n ≤ 4) là
A. n
B. 2n
C. 2n2
D. n2
Đáp án: C
Giải thích:
Câu 10. Khẳng định sai là
A. Các phân lớp s2, p6, d10, f14 chứa đủ số electron tối đa gọi là phân lớp bão hòa.
B. Các phân lớp s1, p3, d5, f7 chứa một nửa số electron tối đa gọi là phân lớp nửa bão hòa.
C. Các phân lớp chưa đủ số electron tối đa gọi là phân lớp chưa bão hòa.
D. Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối thiểu.
Đáp án: D
Giải thích:
Theo quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
Do đó khẳng định D là khẳng định sai.
Câu 11. Nguyên tử N có Z = 7. Số electron độc thân trong nguyên tử N là
A. 7
B. 5
C. 3
D. 1
Đáp án: C
Giải thích:
Cấu hình electron nguyên tử của N là: 1s2 2s2 2p3
Cấu hình theo ô orbital của N là:
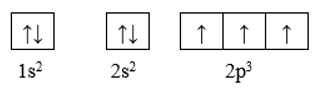
Như vậy nguyên tử N có 3 electron độc thân thuộc AO 2p.
Câu 12. Orbital nguyên tử (kí hiệu là AO) là
A. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%);
B. khu vực không gian trong hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%);
C. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là nhỏ nhất (khoảng 10%);
D. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy proton trong khu vực đó là nhỏ nhất (khoảng 10%).
Đáp án: A
Giải thích:
Câu 13. Nguyên tử X có cấu hình electron 1s2 2s2 2p6 3s2 3p5. Khẳng định sai là
A. Nguyên tử X có 17 electron;
B. Phân lớp 3p của nguyên tử X chưa bão hòa;
C. Nguyên tử X có 5 electron ở lớp ngoài cùng;
D. Nguyên tử X có 3 lớp electron.
Đáp án: C
Giải thích:
Tổng số electron trên các phân lớp là 2 + 2 + 6 + 2 + 5 = 17 (electron) nên nguyên tử X có 17 electron. ⇒ A đúng
Phân lớp 3p có 5 electron chưa đủ số electron tối đa (6 electron) nên phân lớp 3p chưa bão hòa. ⇒ B đúng
Lớp ngoài cùng là lớp thứ 3 có tổng số electron là 2 + 5 = 7 (electron) nên nguyên tử X có 7 electron ở lớp ngoài cùng. ⇒ C sai
Lớp ngoài cùng là lớp thứ 3 nên nguyên tử X có 3 lớp electron. ⇒ D đúng
Câu 14. Nguyên tố Y có 2 lớp electron, lớp thứ hai có 5 electron. Số hiệu nguyên tử của Y là
A. 2
B. 5
C. 7
D. 9
Đáp án: C
Giải thích:
Có 2 lớp electron ⇒ lớp ngoài cùng là lớp thứ 2.
Mà lớp thứ 2 có 5 electron ⇒ cấu hình electron lớp ngoài cùng là: 2s2 2p3
⇒ Cấu hình electron đầy đủ là: 1s2 2s2 2p3 ⇒ số electron = 2 + 2 + 3 = 7
Số hiệu nguyên tử Z = số electron = 7.
Câu 15. Cho nguyên tố A có Z = 11. A là nguyên tố
A. kim loại
B. phi kim
C. khí hiếm
D. có thể là kim loại hoặc phi kim
Đáp án: A
Giải thích:
A có Z = 11 ⇒ có 11 electron
Cấu hình electron của A là: 1s2 2s2 2p6 3s1 ⇒ A có 1 electron lớp ngoài cùng.
Mà các nguyên tử có 1, 2, 3 electron lớp ngoài cùng là các nguyên tử của nguyên tố kim loại (trừ H, He, B).
Do đó, A là nguyên tố kim loại.
Các câu hỏi trắc nghiệm Hóa 10 sách Chân trời sáng tạo có đáp án, chọn lọc khác: