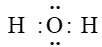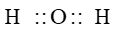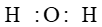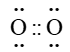Trắc nghiệm Hóa 10 Bài 10: Liên kết cộng hóa trị
Bộ 15 bài tập trắc nghiệm Hóa 10 Bài 10: Liên kết cộng hóa trị có đáp án đầy đủ gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hóa 10 Bài 10.
Trắc nghiệm Hóa 10 Bài 10: Liên kết cộng hóa trị - Chân trời sáng tạo
Câu 1. Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
A. NaCl
B. CH4
C. H2O
D. HCl
Đáp án: B
Giải thích:
∆χ = χ(Cl) - χ(Na) = 3,16 - 0,93 = 2,23 ≥ 1,7 ⇒ Liên kết trong phân tử NaCl là liên kết ion.
∆χ = χ(C) - χ(H) = 2,55 - 2,2 = 0,35 < 0,4 ⇒ Liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực.
∆χ = χ(O) - χ(H) = 3,44 - 2,2 = 1,24 mà 0,4 < 1,24 < 1,7 ⇒ Liên kết trong phân tử H2O là liên kết cộng hóa trị có cực.
∆χ = χ(Cl) - χ(H) = 3,16 - 2,2 = 0,96 mà 0,4 < 0,96 < 1,7 ⇒ Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Câu 2. Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành mấy loại?
A. 2 loại: liên kết σ và liên kết π
B. 2 loại: liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực
C. 3 loại: liên kết đơn, liên kết đôi và liên kết ba
D. 2 loại: liên kết đơn và liên kết đôi
Đáp án: C
Giải thích:
Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành 3 loại:
+ Liên kết đơn (1 cặp electron chung)
+ Liên kết đôi (2 cặp electron chung)
+ Liên kết ba (3 cặp electron chung).
Câu 3. Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào
A. số cặp electron chung
B. sự xen phủ các orbital
C. vị trí của các cặp electron chung
D. vị trí của các electron hóa trị riêng
Đáp án: C
Giải thích:
Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào vị trí của các cặp electron chung.
+ Liên kết cộng hóa trị không phân cực: cặp electron chung không lệch về phía nguyên tử nào.
+ Liên kết cộng hóa trị phân cực: cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Câu 4. Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bằng
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. một cặp electron chung
C. một hay nhiều cặp electron chung
D. các electron hóa trị riêng
Đáp án: C
Giải thích:
Câu 5. Trong phân tử N2, mỗi nguyên tử N đã góp 3 electron để tạo cặp electron chung. Nhờ đó mỗi nguyên tử N đã đạt cấu hình electron bền vững của khí hiếm
A. Xe
B. Ne
C. Ar
D. Kr
Đáp án: B
Giải thích:
N (Z = 7): 1s22s22p3 có 5 electron lớp ngoài cùng ⇒ mỗi nguyên tử N góp 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.

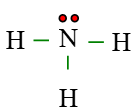
Câu 6. Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung của N là
A. 2 electron dùng chung
B. 3 electron dùng chung
C. 6 electron dùng chung
D. 5 electron dùng chung
Đáp án: C
Giải thích:
Câu 7. Công thức biểu diễn cấu tạo nguyên tử qua các liên kết và các electron hóa trị riêng là
A. công thức phân tử
B. công thức electron
C. công thức Lewis
D. công thức đơn giản nhất
Đáp án: C
Giải thích:
Câu 8. Trong một phân tử CO2 có số cặp electron chung là
A. 1
B. 2
C. 3
D. 4
Đáp án: D
Giải thích:
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
C (Z = 6): [He]2s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ xu hướng nhận 4 electron để đạt cấu hình electron bền vững ⇒ góp 4 electron tạo 4 cặp electron dùng chung với O.
Sự hình thành liên kết cộng hóa trị trong phân tử CO2:
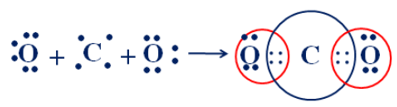
Vậy trong một phân tử CO2 có 4 cặp electron chung.
Câu 9. Công thức electron của phân tử H2O là
A.
B.
C.
D.
Đáp án: A
Giải thích:
H (Z = 1): 1s1 ⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm He ⇒ góp 1 electron.
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron tạo hai cặp electron dùng chung với H.
Công thức electron của phân tử H2O là:
Câu 10. Liên kết trong phân tử nào dưới đây là liên kết đôi?
A. NH3
B. HCl
C. O2
D. N2
Đáp án: C
Giải thích:
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
Công thức electron của phân tử O2 là:
Công thức cấu tạo là: O = O
Vậy liên kết trong phân tử O2 là liên kết đôi.
Câu 11. Dựa vào giá trị độ âm điện, liên kết giữa nguyên tử H và Cl thuộc loại
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết đơn
Đáp án: B
Giải thích:
Có χ(H) = 2,2 và χ(Cl) = 3,16
Nên ∆χ = χ(Cl) - χ(H) = 3,16 - 2,2 = 0,96
Mà 0,4 < 0,96 < 1,7 ⇒ liên kết giữa nguyên tử H và Cl thuộc loại liên kết cộng hóa trị có cực.
Câu 12. Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là
A. liên kết bội
B. liên kết đơn
C. liên kết đôi
D. liên kết ba
Đáp án: B
Giải thích:
Câu 13. Khẳng định sai là
A. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết σ
B. Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi π
C. Liên kết đơn còn gọi là liên kết π
D. Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
Đáp án: C
Giải thích:
Liên kết đơn còn gọi là liên kết π là khẳng định sai.
Sửa lại: Liên kết đơn còn gọi là liên kết σ.
Câu 14. Các AO xen phủ tạo liên kết đơn trong phân tử Cl2 là
A. 2 AO s xen phủ trục tạo liên kết đơn
B. 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
C. 2 AO p xen phủ trục tạo liên kết đơn
D. 2 AO ps xen phủ bên tạo liên kết đơn
Đáp án: C
Giải thích:
Cl (Z = 17): [Ne]3s23p5
Ô orbital của lớp electron ngoài cùng:
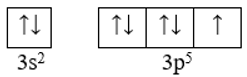
Có 1 AO p chứa electron độc thân.
Do đó liên kết đơn giữa 2 nguyên tử Cl trong phân tử Cl2 được tạo nên từ sự xen phủ trục của 2 AO p.
Câu 15. Cho các phân tử HF, HBr, HI, HCl. Sắp xếp theo chiều tăng dần độ bền liên kết là
A. HF, HBr, HI, HCl
B. HI, HBr, HCl, HF
C. HF, HCl, HBr, HI
D. HBr, HI, HF, HCl
Đáp án: B
Giải thích:
Năng lượng liên kết của liên kết H – F trong phân tử HF là 565 kJ mol-1.
Năng lượng liên kết của liên kết H – Cl trong phân tử HCl là 431 kJ mol-1.
Năng lượng liên kết của liên kết H – Br trong phân tử HBr là 364 kJ mol-1.
Năng lượng liên kết của liên kết H – I trong phân tử HI là 297 kJ mol-1.
Do đó, năng lượng liên kết của liên kết trong HF > HCl > HBr > HI.
Giá trị năng lượng liên kết là thức đo độ bền liên kết nên năng lượng liên kết càng lớn thì liên kết càng bền.
Vậy sắp xếp theo chiều tăng dần độ bền liên kết là HI, HBr, HCl, HF.
Các câu hỏi trắc nghiệm Hóa 10 sách Chân trời sáng tạo có đáp án, chọn lọc khác: