Trắc nghiệm Hóa học 9 Bài 7 có đáp án năm 2021 - 2022
Để giúp học sinh có thêm tài liệu tự luyện môn Hóa học lớp 9 năm 2021 đạt kết quả cao, chúng tôi biên soạn Trắc nghiệm Hóa học 9 Bài 7 có đáp án mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao.
Trắc nghiệm Hóa học 9 Bài 7: Tính chất hóa học của bazơ
Bài 1: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ cần dùng thêm 1 hóa chất nào sau đây để nhận biết các dung dịch trên?
A. quỳ tím
B. dung dịch BaCl2
C. dung dịch KCl
D. dung dịch KOH
Lời giải
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
Đáp án: A
Bài 2: Cho 18,8 gam kali oxit K2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ. Thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên là
A. 85,96 ml
B. 171,92 ml
C. 128,95 ml
D. 214,91 ml
Lời giải
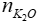 = 0,2 mol
= 0,2 mol
K2O + H2O → 2KOH
0,2 mol → 0,4 mol
2KOH + H2SO4 → K2SO4 + H2O
0,4 → 0,2 mol
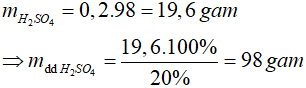
Áp dụng công thức: m = D.V => 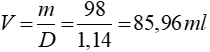
Đáp án: A
Bài 3: Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. Khối lượng dung dịch NaOH cần dùng là:
A. 100 g
B. 80 g
C. 90 g
D. 150 g
Lời giải
nH2SO4 = VH2SO4 . CM H2SO4 = 0,2 . 1 = 0,2mol
PTHH: 2NaOH + H2SO4 → Na2SO4 + H2O
2 mol 1 mol
? mol 0,2mol
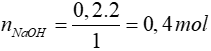
m NaOH= n NaOH.MNaOH = 0,4 . (23 + 16 + 1) = 16g
C% = mNaOH : m dd NaOH
=> mddNaOH = mNaOH : C% = 16 : 20% = 80g
Đáp án: B
Bài 4: Hòa tan 6,2 gam Na2O vào nước dư thu được dung dịch X. Cho X vào 200 gam dung dịch CuSO4 16% thu được a gam kết tủa. Giá trị của a là
A. 4,9 gam
B. 7,4 gam
C. 9,8 gam
D. 11,8 gam
Lời giải
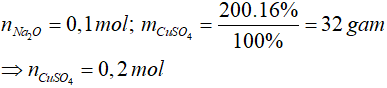
Na2O + H2O → 2NaOH
0,1 mol → 0,2 mol
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Xét tỉ lệ: 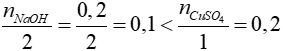
=> CuSO4 dư, NaOH phản ứng hết
=> phản ứng tính theo NaOH
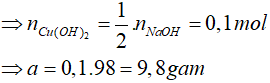
Đáp án: C
Bài 5: Trung hòa 300 ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
A. 90 gam
B. 100 gam
C. 180 gam
D. 117 gam
Lời giải
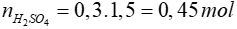
2NaOH + H2SO4 → Na2SO4 + H2O
0,9 mol ← 0,45 mol
=> mNaOH = 0,9.40 = 36 gam => mdd NaOH = 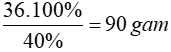
Đáp án: A

Bài 6: Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?
A. Cho dd Ca(OH)2 dư phản ứng với SO2
B. Cho dd NaOH phản ứng với dd H2SO4
C. Cho Cu(OH)2 phản ứng với HCl
D. Nung nóng Cu(OH)2
Lời giải
Cho dd Ca(OH)2 phản ứng với SO2
Ca(OH)2 + SO2 → CaSO3 + H2O
=> không tạo ra oxit bazơ
Cho dd NaOH phản ứng với dd H2SO4
2NaOH + H2SO4 → Na2SO4 + H2O
=> không tạo ra oxit bazơ
Cho Cu(OH)2 phản ứng với HCl
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
=> không tạo ra oxit bazơ
Nung nóng Cu(OH)2
Cu(OH)2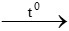 CuO + H2O
CuO + H2O
=> tạo ra oxit bazơ là CuO
Đáp án: D
Bài 7: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi
B. Màu xanh nhạt dần rồi mất hẳn
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ
D. Màu xanh đậm thêm dần
Lời giải
Nhỏ dung dịch HCl vào dung dịch KOH có phản ứng sau:
HCl + KOH → KCl + H2O
KCl là muối không làm đổi màu quỳ tím nên đến khi HCl phản ứng vừa đủ với KOH thì màu xanh của dung dịch nhạt dần và mất hẳn. Tiếp tục nhỏ dung dịch HCl tới dư thì trong dung dịch lúc này chứa HCl và KCl, HCl là axit làm quỳ chuyển đỏ => dung dịch chuyển sang màu đỏ
Đáp án: C
Bài 8: Cho vài giọt dd Phenolphtalein không màu vào dung dịch NaOH. Hiện tượng xảy ra là:
A. dd không màu
B. dd màu xanh
C. kết tủa trắng
D. dd màu hồng
Lời giải
Dung dịch bazo làm phenolphtalein chuyển màu hồng
Đáp án: D
Bài 9: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magie giải phóng khí hiđro
D. Không làm đổi màu quỳ tím
Lời giải
PTHH: Ba(OH)2 + 2HCl → BaCl2 + H2O
Xét tỉ lệ: 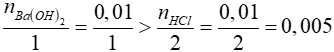
=> Ba(OH)2 dư, HCl phản ứng hết
=> Dung dịch sau phản ứng thu được gồm BaCl2 và Ba(OH)2 dư
Vì BaCl2 là muối, không làm đổi màu quỳ, còn Ba(OH)2 là bazơ làm quỳ hóa xanh
=> dung dịch thu được sau phản ứng làm quỳ hóa xanh
Đáp án: A
Bài 10: Nhiệt phân hoàn toàn 19,6 gam Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
A. 6,4 gam
B. 9,6 gam
C. 12,8 gam
D. 16 gam
Lời giải
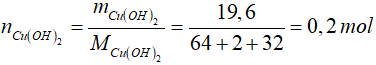
Cu(OH)2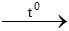 CuO + H2O
CuO + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => 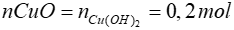
CuO + H2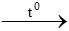 Cu + H2O
Cu + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCu = nCuO= 0,2 mol
=> mCu = nCu . MCu = 0,2 . 64 = 12,8 gam
Đáp án: C
Bài 11: Từ những chất có sẵn là Na2O, CaO, MgO, CuO, Fe2O3, K2O và H2O, có thể điều chế được bao nhiêu dung dịch bazơ?
A. 1
B. 2
C. 3
D. 4
Lời giải
Các oxit bazơ tan trong nước tạo thành dung dịch bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH
Đáp án: C
Bài 12: Cần bao nhiêu lít dung dịch NaOH 0,5M để trung hoà 400 ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M?
A. 1,5 lít
B. 0,5 lít
C. 1,6 lít
D. 1,0 lít
Lời giải
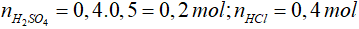
Phương trình phản ứng:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,2 → 0,4 (mol)
HCl + NaOH → NaCl + H2O
0,4 → 0,4 (mol)
=> ∑nNaOH = 0,4 + 0,4 = 0,8 mol
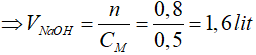
Đáp án: C
Bài 13: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%:
A. 400 g
B. 500 g
C. 420 g
D. 570 g
Lời giải
mKOH = mddKOH . C% = 112 . 25% = 28g
=> nKOH = mKOH : MKOH = 28 : 56 = 0,5 mol
2KOH + H2SO4 → K2SO4 + H2O
2 mol 1 mol
0,5 mol ?mol
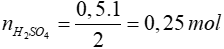
mH2SO4 = n H2SO4.MH2SO4 = 0,25 . (2 + 32 + 64) = 24,5g
C% = mH2SO4 : m dd H2SO4
=> mddH2SO4 = mH2SO4 : C% = 24,5 : 4,9% = 500g
Đáp án: B
Bài 14: Để nhận biết các dung dịch sau: H2SO4, NaOH, HCl, người ta dùng
A. quỳ tím và dung dịch BaCl2.
B. quỳ tím và dung dịch KOH.
C. phenolphtalein.
D. phenolphtalein và dung dịch NaCl.
Lời giải
Dùng quỳ tím:
+ NaOH làm quỳ chuyển màu xanh
+ H2SO4, HCl làm quỳ chuyển màu đỏ
Dùng BaCl2 nhận 2 dung dịch axit:
+ Có kết tủa trắng là H2SO4
H2SO4 + BaCl2 → BaSO4 +2HCl
+ Không có hiện tượng gì là HCl
Đáp án: A
Bài 15: Có 3 lọ mất nhãn đựng các hóa chất sau : HCl , H2SO4 , NaOH. Hãy chọn thuốc thử nào sau đây để nhận biết dung dịch trong mỗi lọ ?
A. Dùng quì tím
B. Dùng dung dịch BaCl2
C. Dùng quì tím và dung dịch BaCl2
D. Dùng quì tím và dung dịch phenol phtalein
Lời giải
Cho quỳ tím lần lượt vào các dung dịch trên:
+ Quỳ tím chuyển sang màu xanh: NaOH
+ Quỳ tím chuyển sang màu đỏ (II): HCl, H2SO4
- Cho dung dịch BaCl2 vào 2 lọ ở dãy (II)
+ Dung dịch xuất hiện kết tủa trắng là H2SO4, còn lại không có hiện tượng là HCl.
BaCl2 + H2SO4 → BaSO4↓+ HCl
Đáp án: C


