Giải Khoa học tự nhiên 7 (Kết nối tri thức) Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Hoidapvietjack.com trân trọng giới thiệu: lời giải bài tập Khoa học tự nhiên lớp 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 4.
Giải bài tập Khoa học tự nhiên 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Video giải Khoa học tự nhiên 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
A/ Câu hỏi đầu bài
Mở đầu trang 23 Bài 4 Khoa học tự nhiên 7: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng không?
Trả lời:
Bảng tuần hoàn được xây dựng theo nguyên tắc sau:
- Các nguyên tố hóa học được sắp xếp vào bảng tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng một cột có tính chất gần giống nhau.
B/ Câu hỏi giữa bài
I. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
Hoạt động trang 23 Khoa học tự nhiên 7: Sắp xếp các nguyên tố hóa học
Chuẩn bị:
- 18 thẻ ghi thông tin của 18 nguyên tố đầu tiên theo mẫu trong Hình 4.1.
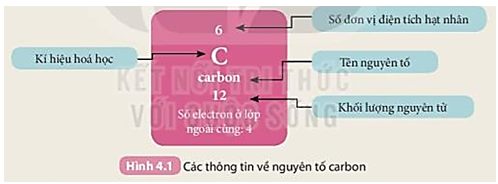
- Bảng mẫu:
Tiến hành: gắn các thẻ vào bảng mẫu ở trên từ trái qua phải, từ trên xuống dưới, mỗi thẻ vào 1 ô theo chiều tăng dần số đơn vị điện tích hạt nhân của các nguyên tố.
Thảo luận nhóm và nhận xét về các đặc điểm của bảng sau khi đã sắp xếp:
1. Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải.
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột.
Trả lời:
Các tấm thẻ được gắn như sau:
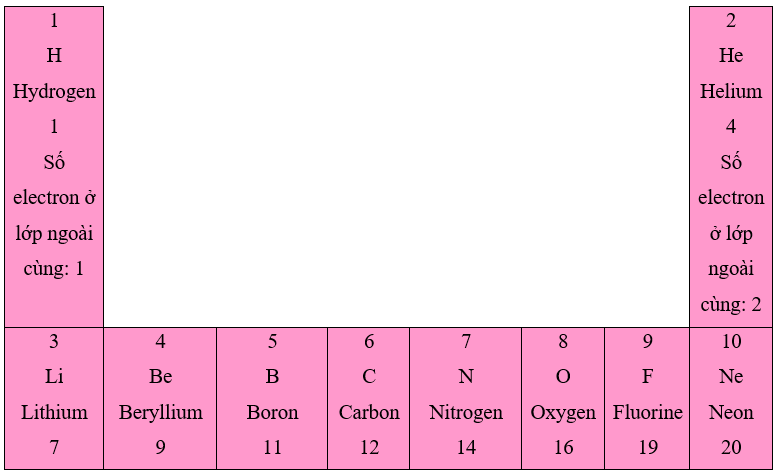
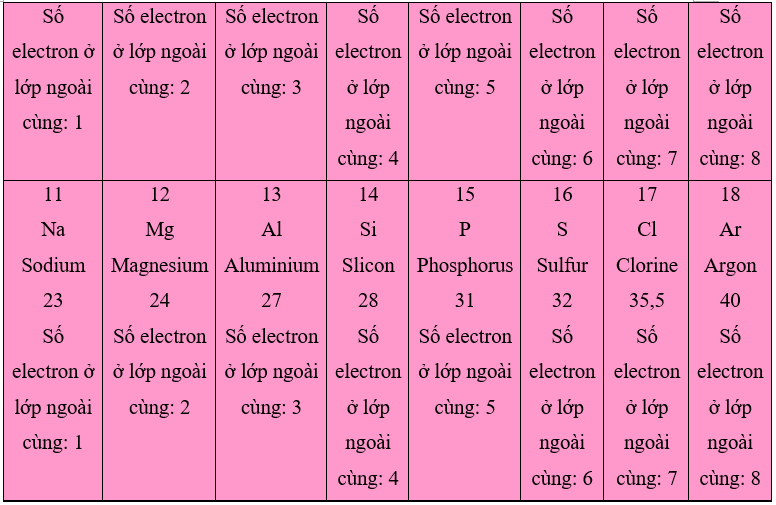
1. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải tăng dần từ 1 đến 8.
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột bằng nhau.
Câu hỏi 1 trang 24 Khoa học tự nhiên 7:Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
Trả lời:
Dựa vào các đặc điểm về điện tích hạt nhân, số lớp electron, số electron lớp ngoài cùng của nguyên tử các nguyên tố để sắp xếp chúng vào hàng, cột trong bảng tuần hoàn.
Bảng tuần hoàn được xây dựng theo nguyên tắc sau:
- Các nguyên tố hóa học được sắp xếp vào bảng tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng một cột có tính chất gần giống nhau. (Các nguyên tố trong cùng một cột có số electron lớp ngoài cùng bằng nhau, chính các electron lớp ngoài cùng này quyết định tính chất của nguyên tố).
Câu hỏi 2 trang 24 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
Trả lời:
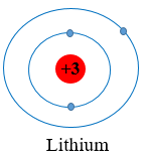
- Nguyên tử Li (Z = 3): Có 3 electron được sắp xếp vào hai lớp
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 1 electron
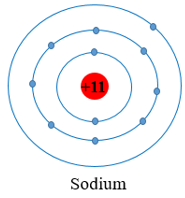
- Nguyên tử Na (Z = 11): có 11 electron được sắp xếp vào ba lớp
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba có 1 electron.
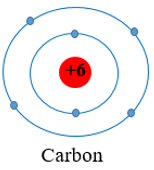
- Nguyên tử C (Z = 6): có 6 electron được sắp xếp vào hai lớp
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 4 electron
- Nguyên tử O (Z = 8): có 8 electron được sắp xếp vào hai lớp
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 6 electron.
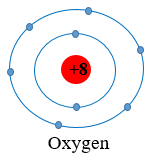
Vậy nguyên tố lithium (Li), carbon (C), oxygen (O) đều cùng có 2 lớp electron trong nguyên tử.
II. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
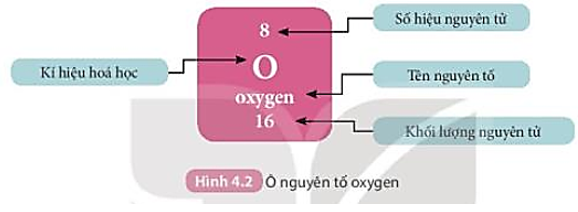
Câu hỏi 1 trang 26 Khoa học tự nhiên 7: Quan sát Hình 4.2, cho biết số proton, electron trong nguyên tử oxygen.
Trả lời:
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = Số electron trong nguyên tử = 8
Vậy nguyên tử oxygen có 8 proton và 8 electron trong nguyên tử.
Câu hỏi 2 trang 26 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn và cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6, 11.
Trả lời:
|
Số thứ tự ô |
Số hiệu nguyên tử |
Tên nguyên tố |
Kí hiệu hóa học |
Khối lượng nguyên tử |
|
6 |
6 |
Carbon |
C |
12 amu |
|
11 |
11 |
Sodium |
Na |
23 amu |
2. Chu kì
Hoạt động trang 27 Khoa học tự nhiên 7:Tìm hiểu mối quan hệ giữa số lớp electron của nguyên tử các nguyên tố với số thứ tự của chu kì
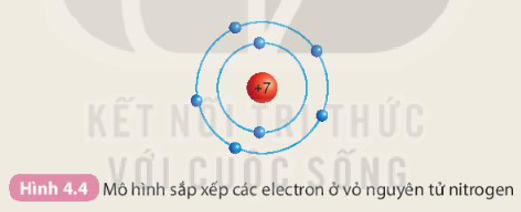
Chuẩn bị: 6 mô hình sắp xếp electron ở vỏ nguyên tử của sáu nguyên tố H, He, Li, Be, C. N theo mẫu được mô tả trong Hình 4.4.
Quan sát các mô hình đã chuẩn bị, thảo luận và thực hiện các yêu cầu sau:
1. Hãy cho biết số lớp electron của nguyên tử các nguyên tố trên.
2. So sánh số lớp electron của nguyên tử các nguyên tố trên với số thứ tự chu kì của các nguyên tố đó.
Trả lời:
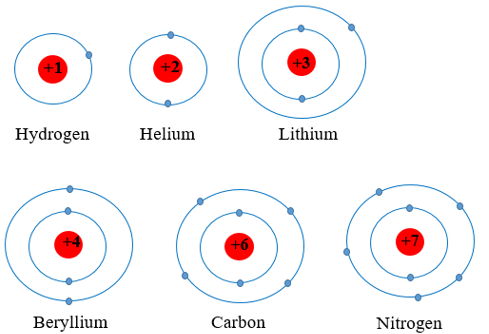
Mô hình sắp xếp các electron ở nguyên tử
1.
|
Nguyên tử |
H |
He |
Li |
Be |
C |
N |
|
Số lớp electron |
1 |
1 |
2 |
2 |
2 |
2 |
2. Nguyên tố H, He thuộc chu kì 1
Nguyên tố Li, Be, C, N thuộc chu kì 2
⇒ Số lớp electron của nguyên tử các nguyên tố = số thứ tự chu kì của các nguyên tố đó.
Câu hỏi 1 trang 27 Khoa học tự nhiên 7: Quan sát Hình 4.3 và cho biết tên, kí hiệu hóa học và điện tích hạt nhân của nguyên tử các nguyên tố xung quanh nguyên tố carbon.
Trả lời:
Xung quanh carbon có 3 nguyên tố là boron, nitrogen, silicon
- Boron (kí hiệu là B) có điện tích hạt nhân +5.
- Nitrogen (kí hiệu là N) có điện tích hạt nhân là +7.
- Silicon (kí hiệu là Si) có điện tích hạt nhân là +14.
Câu hỏi 2 trang 27 Khoa học tự nhiên 7: Hãy cho biết số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3. Giải thích.
Trả lời:
Số thứ tự chu kì = số lớp electron nguyên tử nguyên tố.
Các nguyên tố thuộc chu kì 3 ⇒ nguyên tử của nguyên tố có 3 lớp electron.
3. Nhóm
Hoạt động trang 28 Khoa học tự nhiên 7: Tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự của nhóm
Chuẩn bị: 4 mô hình sắp xếp electron ở vỏ nguyên tử của Li, Na, F, Cl theo mẫu mô tả trong Hình 4.4.
Quan sát các mô hình đã chuẩn bị, thảo luận và trả lời các câu hỏi:
1. Hãy cho biết nguyên tử các nguyên tố nào có cùng số electron ở lớp ngoài cùng.
2. Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó.
Trả lời:
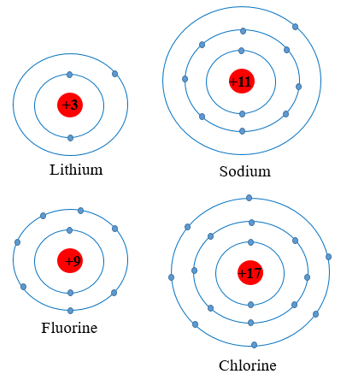
Mô hình sắp xếp các electron ở vỏ nguyên tử
1. Nguyên tử các nguyên tố Li, Na cùng có 1 electron ở lớp ngoài cùng.
Nguyên tử các nguyên tố F, Cl cùng có 7 electron ở lớp ngoài cùng.
2. Các nguyên tố Li, Na thuộc nhóm IA trong bảng tuần hoàn.
Các nguyên tố F, Cl thuộc nhóm VIIA trong bảng tuần hoàn.
⇒ Số electron ở lớp ngoài cùng của nguyên tử nguyên tố = số thứ tự nhóm A
Câu hỏi trang 29 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn, hãy cho biết:
1. Số electron lớp ngoài cùng của nguyên tử hai nguyên tố Al và S. Giải thích.
2. Hãy kể tên nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố beryllium.
Trả lời:
1. Số thứ tự nhóm A = Số electron ở lớp ngoài cùng của nguyên tử nguyên tố.
Dựa vào bảng tuần hoàn ta thấy:
- Nguyên tố Al thuộc nhóm IIIA ⇒ nguyên tử Al có 3 electron lớp ngoài cùng.
- Nguyên tố S thuộc nhóm VIA ⇒ nguyên tử S có 6 electron lớp ngoài cùng.
2. Chú ý:
- Chu kì 1, 2, 3 được gọi là các chu kì nhỏ.
- Chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
Dựa vào bảng tuần hoàn, ta thấy nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố beryllium (Be) là magnesium (Mg).
III. Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
1. Các nguyên tố kim loại
Câu hỏi 1 trang 30 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn, hãy xác định vị trí (số thứ tự, chu kì, nhóm) của các nguyên tố Al, Ca, Na.
Trả lời:
Dựa vào bảng tuần hoàn, ta xác định được:
+ Nguyên tố Al nằm ở ô thứ 13, chu kì 3, nhóm IIIA.
+ Nguyên tố Ca nằm ở ô thứ 20, chu kì 4, nhóm IIA.
+ Nguyên tố Na nằm ở ô thứ 11, chu kì 3, nhóm IA.
Câu hỏi 2 trang 30 Khoa học tự nhiên 7: Tính chất nào của nhôm, sắt, đồng đã được dùng trong các ứng dụng ở trong Hình 4.6?
Trả lời:
- Nhôm (Al) được dùng làm màng bọc thực phẩm vì nhôm dễ dát mỏng.
- Đồng (Cu) được dùng làm lõi dây điện vì đồng dễ uốn, dẫn điện tốt.
- Sắt (Fe) được dùng trong các công trình xây dựng vì sắt cứng, chịu lực tốt, bền.
2. Các nguyên tố phi kim
Câu hỏi trang 30 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn, hãy xác định vị trí (số thứ tự, chu kì, nhóm) của các nguyên tố có tên trong Hình 4.7

Trả lời:
Dựa vào bảng tuần hoàn ta xác định được:
- Oxygen (O) thuộc ô số 8, chu kì 2, nhóm VIA.
- Chlorine (Cl) thuộc ô số 17, chu kì 3, nhóm VIIA.
- Sulfur (S) thuộc ô số 16, chu kì 3, nhóm VIA.
- Bromine (Br) thuộc ô số 35, chu kì 4, nhóm VIIA.
3. Các nguyên tố khí hiếm
Câu hỏi 1 trang 31 Khoa học tự nhiên 7: Sử dụng bảng tuần hoàn, hãy xác định vị trí (số thứ tự, chu kì, nhóm) của khí hiếm neon.
Trả lời:
Dựa vào bảng tuần hoàn, nguyên tố neon (Ne) thuộc ô số 10, chu kì 2, nhóm VIIIA.
Câu hỏi 2 trang 31 Khoa học tự nhiên 7: Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố:
A. Kim loại và phi kim
B. Phi kim và khí hiếm
C. Kim loại và khí hiếm
D. Kim loại, phi kim và khí hiếm.
Hãy chọn đáp án đúng nhất.
Trả lời:
Đáp án đúng là: D
Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố kim loại, phi kim và khí hiếm.
Câu hỏi 3 trang 31 Khoa học tự nhiên 7: Cho các nguyên tố sau:
b) Nêu ứng dụng trong đời sống của một nguyên tố trong số các nguyên tố trên.
Trả lời:
a) Chú ý: Trong bảng tuần hoàn:
- Các nguyên tố kim loại được thể hiện bằng màu xanh.
- Các nguyên tố phi kim được thể hiện bằng màu hồng.
- Các nguyên tố khí hiếm được thể hiện bằng màu vàng.
Dựa vào bảng tuần hoàn ta xác định được
Nguyên tố kim loại: Ba, Rb, Cu, Fe.
Nguyên tố phi kim: P, Si.
Ngoài ra nguyên tố Ne là khí hiếm.
b) Ứng dụng trong đời sống của một nguyên tố trong số các nguyên tố trên:
- Copper (Cu): làm lõi dây dẫn điện, que hàn đồng, đúc tượng, nam châm điện từ, các động cơ máy móc,…
- Iron (Fe): Dùng để chế tạo các đồ dùng gia đình như dao, kéo, bàn ghế, máy giặt, bồn rửa bát; xây dựng công trình (nhà, cầu, đường sắt,…); khung xe (xe máy, xe đạp, ô tô,…);…
- Silicon (Si): là thành phần cơ bản tạo nên thủy tinh, ngoài ra được dùng làm chất bán dẫn trong các linh kiện điện tử, thành phần cấu tạo nên thép, gạch, xi măng,...
- Phosphorus (P): là nguyên liệu để sản xuất diêm, các loại thuốc súng, bom, đạn khói, phân bón,..
Bài giảng Khoa học tự nhiên lớp 7 Kết nối tri thức




