Sách bài tập Hóa học 10 Bài 16 Chân trời sáng tạo: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Với giải sách bài tập Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học. sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 16.
Giải sách bài tập Hóa học lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học - Chân trời sáng tạo
Bài 16.1 trang 67 SBT Hóa học 10. Khi tăng nồng độ chất tham gia, thì
C. không ảnh hưởng đến tốc độ phản ứng
D. có thể tăng hoặc giảm tốc độ phản ứng.
Lời giải:
Đáp án đúng là: A.
Khi tăng nồng độ chất tham gia, thì tốc độ phản ứng tăng.
Bài 16.2 trang 67 SBT Hóa học 10. Yếu tố nào sau đây làm giảm tốc độ phản ứng
A. Sử dụng enzyme cho phản ứng.
B. Thêm chất ức chế vào hỗn hợp chất tham gia.
D. Nghiền chất tham gia dạng khối thành bột
Lời giải:
Đáp án đúng là: B.
Thêm chất ức chế vào hỗn hợp chất tham gia làm giảm tốc độ của phản ứng.
Bài 16.3 trang 67 SBT Hóa học 10. Các enzyme là chất xúc tác, có chức năng:
A. Giảm năng lượng hoạt hóa của phản ứng.
B. Tăng năng lượng hoạt hóa của phản ứng.
D. Giảm nhiệt độ của phản ứng.
Lời giải:
Đáp án đúng là: A.
Các enzyme là chất xúc tác, có chức năng giảm năng lượng hoạt hóa của phản ứng.
Bài 16.4 trang 67 SBT Hóa học 10. Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng:
B. Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ, …).
D. Tỉ trọng của chất phản ứng.
Lời giải:
Đáp án đúng là: D.
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, nhiệt độ, áp suất, chất xúc tác, diện tích bề mặt.
Vậy tỉ trọng của chất phản ứng không ảnh hưởng đến tốc độ phản ứng.
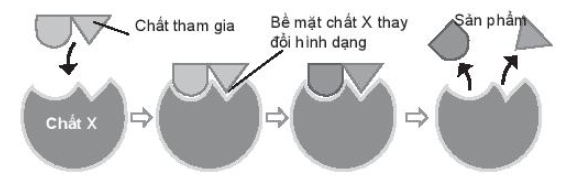
Bài 16.5 trang 67 SBT Hóa học 10. Sản phẩm của phản ứng được tạo ra qua các bước theo hình bên dưới:
B. làm tăng năng lượng hoạt hóa của chất tham gia phản ứng.
C. làm giảm năng lượng hoạt hóa của chất tham gia phản ứng.
D. làm tăng nồng độ chất tham gia phản ứng.
Lời giải:
Đáp án đúng là: C.
Theo hình ảnh xác định chất X là chất xúc tác, có vai trò làm giảm năng lượng hoạt hóa của chất tham gia phản ứng.
Bài 16.6 trang 68 SBT Hóa học 10. Tốc độ của một phản ứng hóa học
A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
B. tăng khi nhiệt độ của phản ứng tăng.
C. càng nhanh khi giá trị năng lượng hoạt hóa càng lớn.
D. không phụ thuộc vào diện tích bề mặt.
Lời giải:
Đáp án đúng là: B.
Tốc độ của một phản ứng hóa học tăng khi nhiệt độ của phản ứng tăng.
Lời giải:
|
Yếu tổ ảnh hưởng |
Tốc độ phản ứng |
|
Đun nóng chất tham gia |
Tăng |
|
Thêm xúc tác phù hợp |
Tăng |
|
Pha loãng dung dịch |
Giảm |
|
Ngưng dùng enzyme (chất xúc tác) |
Giảm |
|
Giảm nhiệt độ |
Giảm |
|
Tăng nhiệt độ |
Tăng |
|
Giảm diện tích bề mặt |
Giảm |
|
Tăng nồng độ chất phản ứng |
Tăng |
|
Chia nhỏ chất phản ứng thành mảnh nhỏ |
Tăng |
Lời giải:
- Tăng nồng độ: Khi tăng nồng độ các chất tham gia phản ứng, sẽ tạo ra nhiều va chạm hiệu quả, tốc độ phản ứng tăng.
- Tăng nhiệt độ: Khi đun nóng, năng lượng mà các phân tử thu được sẽ chuyển hoá thành động năng, chuyển động với tốc độ nhanh hơn, làm gia tăng tần số va chạm hiệu quả giữa các hạt, tốc độ phản ứng tăng.
- Thêm chất xúc tác: Chất xúc tác làm giảm năng lượng hoạt hoá của chất tham gia phản ứng, phản ứng dễ xảy ra hơn hoặc tăng tốc độ phản ứng.
|
Tình huống |
Yếu tố ảnh hưởng |
|
Duy trì thổi không khí vào bếp để than cháy đều |
|
|
Than đá được nghiền nhỏ dùng trong quá trình luyện kim loại |
|
|
Thức ăn được tiêu hóa tỏng dạ dày nhờ acid và enzyme |
|
|
Xác của một số loài động vật được bảo quản nguyên vẹn ở Bắc cực và Nam cực hàng ngàn năm |
|
|
Vụ nổ bụi xảy ra tại một xưởng cưa |
|
Lời giải:
|
Tình huống |
Yếu tố ảnh hưởng |
|
Duy trì thổi không khí vào bếp để than cháy đều |
Nồng độ |
|
Than đá được nghiền nhỏ dùng trong quá trình luyện kim loại |
Bề mặt tiếp xúc |
|
Thức ăn được tiêu hoá trong dạ dày nhờ acid và enzyme |
Xúc tác |
|
Xác của một số loài động vật được bảo quản nguyên vẹn ở Bắc cực và Nam cực hàng ngàn năm |
Nhiệt độ |
|
Vụ nổ bụi xảy ra tại một xưởng cưa |
Bề mặt tiếp xúc, nồng độ |
Bài 16.10 trang 69 SBT Hóa học 10.Trong thí nghiệm 3 (SGK trang 102), người ta cân khối lượng chất rắn trước và sau phản ứng thấy không đổi, chứng tỏ chất xúc tác có tham gia như là một chất phản ứng không? Giải thích.
Lời giải:
Khối lượng chất rắn trước và sau phản ứng không thay đổi, chứng tỏ chất xúc tác không phải là chất phản ứng. Trong một số phản ứng, chất xúc tác tham gia phản ứng tạo thành hợp chất trung gian kém bền, sau đó tạo ra sản phẩm và chất xúc tác được bảo toàn về chất và lượng.
Bài 16.11 trang 69 SBT Hóa học 10. Tốc độ các phản ứng sau chịu ảnh hưởng của yếu tố nào?
a. Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự cháy diễn ra mạnh hơn.
b. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt của V2O5.
c. Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
d. Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
e. Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín.
g. Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm, …
Lời giải:
a) Ảnh hưởng bởi yếu tố nồng độ. Than cháy luôn cần oxygen để duy trì sự cháy, khi thổi không khí vào, làm tăng nồng độ oxygen, than cháy mạnh hơn.
b) Ảnh hưởng bởi yếu tố xúc tác. Xúc tác giúp phản ứng dễ xảy ra hơn.
c) Ảnh hưởng bởi yếu tố bề mặt tiếp xúc. Aluminum dạng bột có bề mặt tiếp xúc lớn hơn dạng lá, phản ứng xảy ra nhanh hơn.
d) Ảnh hưởng bởi yếu tố nhiệt độ. Quá trình bảo quản thực phẩm là hạn chế vi khuẩn hoạt động phá huỷ thức ăn, khi bảo quản trong tủ lạnh, nhiệt độ thấp sẽ giảm khả năng hoạt động của vi khuẩn, làm chậm quá trình phá huỷ thức ăn.
e) Ảnh hưởng bởi yếu tố nhiệt độ. Khi tăng áp suất, nhiệt độ sôi của nước tăng, thực phẩm nhanh chín hơn.
g) Ảnh hưởng bởi yếu tố chất xúc tác làm tăng tốc độ quá trình lên men.
Lời giải:
Chè xanh nói riêng, thực phẩm nói chung, luôn chứa những thành phần có lợi cho sức khoẻ con người. Theo cơ địa mỗi người mà thu nạp vào cơ thể lượng thực phẩm phù hợp, cân đối, như người thừa cân dùng thực phẩm ít chất béo, tăng cường chất xơ, kết hợp tập thể dục; người bị Gout hạn chế dùng thực phẩm chứa chất đạm, ... Lá chè xanh chứa nhiều thành phần có tác dụng ngăn ngừa bệnh tật, nhưng ở hàm lượng (yếu tố nồng độ) cao, gây ra những triệu chứng khó chịu, suy giảm sức khoẻ, bệnh tật.
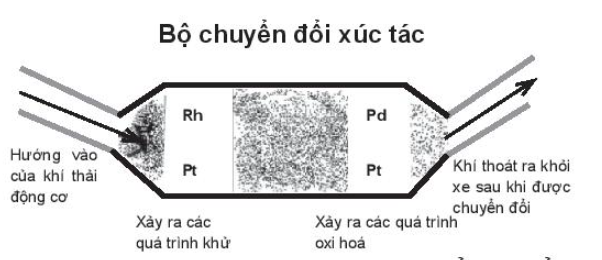
Thiết bị trên vận dụng yếu tố nào để tác động đến phản ứng?
Lời giải:
Thiết bị sử dụng các kim loại quý như Pt, Rh, Pd để thúc đẩy quá trình nhường và nhận electron của các chất có trong khí thải thành những chất ít ô nhiễm môi trường:
Quá trình oxi hoá các hydrocarbon (CxHy), carbon monoxide:
Quá trình khử các oxide của nitrogen:
Chỉ có chất khí trong khí thải tham gia phản ứng, các kim loại Pt, Rh, Pd đóng vai trò chất xúc tác. Yếu tố xúc tác được vận dụng trong thiết bị trên.
Thí nghiệm như hình bên cho thấy, bột mì không dễ cháy. Tại sao bột mì và một số loại bụi khác có thể gây ra nổ bụi? Để ngăn ngừa và hạn chế nổ bụi, có thể can thiệp vào những tác nhân nào?
Lời giải:
Bột mì trên dĩa hay tập trung một chỗ thì rất khó cháy, nếu được phun tơi dạng bụi sẽ dễ cháy hơn, là do bề mặt tiếp xúc tăng lên rất nhiều. Khi đủ 5 tác nhân: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín sẽ gây ra nổ thứ cấp (nổ dây chuyền).
Để ngăn ngừa và hạn chế nổ bụi, có thể can thiệp vào 2 yếu tố chính: giảm nồng độ hạt bụi và kiểm soát nguồn nhiệt trong khu vực sản xuất (hệ thống điện, nguồn điện, ổ cắm, ...).
Lời giải:
Ý (1) vận dụng yếu tố bề mặt tiếp xúc; ý (2) là yếu tố nồng độ, tỉ lệ nhiên liệu - không khí phù hợp đảm bảo các phản ứng xảy ra hoàn toàn; ý (3) là yếu tố nồng độ, khi tăng/ giảm vận tốc, hệ thống sẽ tăng/ giảm tỉ lệ nhiên liệu – không khí tương ứng.
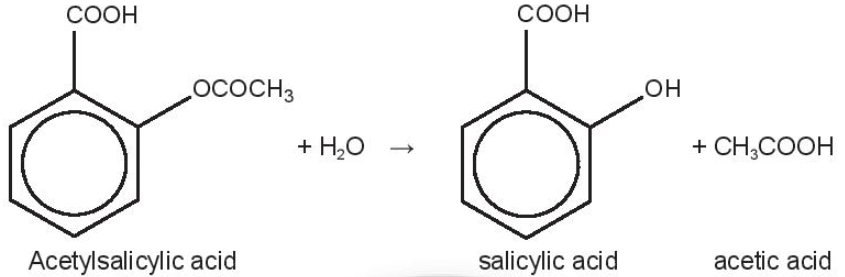
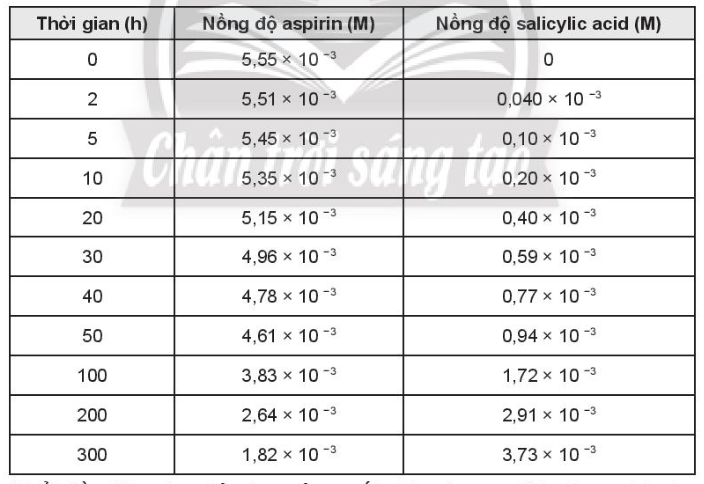
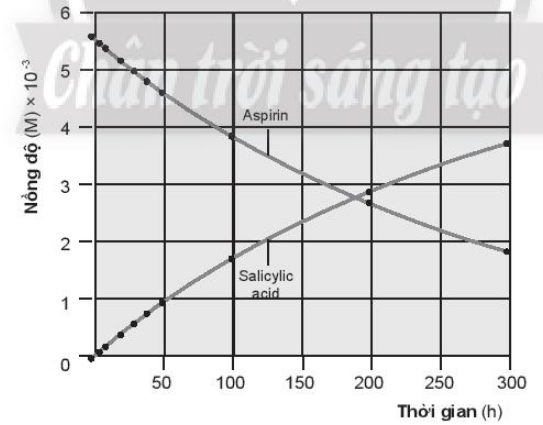
Salicylic acid là thành phần chính có tác dụng hạ sốt, giảm đau và viêm nhiễm, nên có nhiều nghiên cứu tập trung vào phản ứng thủy phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thủy phân của một mẫu aspirin trong nước (môi trường trung tính) ở 37oC(*) thể hiện trong bảng:
(*) Ở điều kiện này, phản ứng xảy ra rất chậm, trong môi trường acid, như điều kiện trong dạ dày, phản ứng xảy ra nhanh hơn.
a. Tính tốc độ trung bình của phản ứng thủy phân aspirin sau thời gian 2, 5, 10, …, 300 giờ.
b. Nhận xét sự thay đổi tốc độ phản ứng theo thời gian. Giải thích.
c. Vẽ đồ thị biểu diễn sự biến thiên nồng độ chất tham gia và sản phẩm theo thời gian của phản ứng trên.
Lời giải:
a) Tốc độ phản ứng của phản ứng thuỷ phân aspirin theo thời gian:
|
Thời gian (h) |
Nồng độ aspirin (M) |
Nồng độ salicylic acid (M) |
Tốc độ phản ứng (M/h) |
|
0 |
5,55 × 10-3 |
0 |
|
|
2 |
5,51 × 10-3 |
0,040 × 10-3 |
2,000 × 10-5 |
|
5 |
5,45 × 10-3 |
0,10 × 10-3 |
2,000 × 10-5 |
|
10 |
5,35 × 10-3 |
0,20 × 10-3 |
2,000 × 10-5 |
|
20 |
5,15 × 10-3 |
0,40 × 10-3 |
2,000 × 10-5 |
|
30 |
4,96 × 10-3 |
0,59 × 10-3 |
1,967 × 10-5 |
|
40 |
4,78 × 10-3 |
0,77 × 10-3 |
1,925 × 10-5 |
|
50 |
4,61 × 10-3 |
0,94 × 10-3 |
1,880 × 10-5 |
|
100 |
3,83 × 10-3 |
1,72 × 10-3 |
1,720 × 10-5 |
|
200 |
2,64 × 10-3 |
2,91 × 10-3 |
1,455 × 10-5 |
|
300 |
1,82 × 10-3 |
3,73 × 10-3 |
1,243 × 10-5 |
b) Trong khoảng thời gian 20 giờ đầu tiên của phản ứng thuỷ phân, nồng độ aspirin đủ lớn để tạo ra số va chạm hiệu quả tương đương nhau, tốc độ trung bình phản ứng đạt 2,000 × 10-5 (M/h), sau đó, tốc độ phản ứng thuỷ phân aspirin chậm dần. Khi nồng độ aspirin giảm, làm giảm tần số va chạm hiệu quả giữa các phân tử, tốc độ phản ứng giảm.
c) Đồ thị biểu diễn sự biến thiên nồng độ chất tham gia và sản phẩm theo thời gian.
 Bài 16.17 trang 72 SBT Hóa học 10. Hoạt động trong phòng thí nghiệm
Bài 16.17 trang 72 SBT Hóa học 10. Hoạt động trong phòng thí nghiệm
Dụng cụ: Cân phân tích, cốc thủy tinh, đồng hồ bấm giây.
Hóa chất: CaCO3 dạng khối, dung dịch HCl 2M.
Bước 1: Cân 5 – 7 viên đá vôi, ghi giá trị m1.
Bước 2: Rót 100 ml dung dịch HCl vào cốc thủy tinh, cân khối lượng cốc, ghi giá trị m2.
1. Vận dụng định luật bảo toàn khối lượng, tính khối lượng khí CO2 sau mỗi 30 giây.
2. Tính tốc độ trung bình của phản ứng sau khoảng thời gian 1, 2, 3, 4 phút.
3. Nhận xét tốc độ phản ứng thay đổi thế nào theo thời gian. Giải thích.
4. Vẽ biểu đồ biểu diễn khối lượng CO2 trong các thời điểm khác nhau.
Lời giải:
Học sinh tiến hành thí nghiệm và thực hiện các yêu cầu có trong thí nghiệm.