Sách bài tập Hóa học 10 Chân trời sáng tạo: Ôn tập chương 7
Với giải sách bài tập Hóa học 10 Ôn tập chương 7 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Ôn tập.
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 7 - Chân trời sáng tạo
OT7.1 trang 83 SBT Hóa học 10. Cấu hình electron nào của nguyên tử halogen?
Lời giải:
Đáp án đúng là: C.
Nguyên tử halogen có 7 electron ở lớp ngoài cùng.
Vậy cấu hình 1s22s22p63s23p5 của halogen.
OT7.2 trang 83 SBT Hóa học 10. Dung dịch AgNO3 không tác dụng với dung dịch:
Lời giải:
Đáp án đúng là: B
NaF không tác dụng với AgNO3.
OT7.3 trang 83 SBT Hóa học 10. Phương trình hóa học nào viết sai?
Lời giải:
Đáp án đúng là: D
D sai vì 2Fe + 3Cl2 → 2FeCl3.
OT7.4 trang 83 SBT Hóa học 10. Nước chlorine có tính tẩy màu là do:
B. Cl2 vừa có tính khử vừa có tính oxi hóa.
Lời giải:
Đáp án đúng là: C
Nước chlorine có tính tẩy màu là do HClO có tính oxi hóa mạnh.
OT7.5 trang 83 SBT Hóa học 10. Halogen không có tính khử là
Lời giải:
Đáp án đúng là: A.
Fluorine chỉ có tính oxi hóa.
OT7.6 trang 83 SBT Hóa học 10. Phương trình hóa học của 2 phản ứng như sau:
So sánh tính khử của các ion halide qua 2 phản ứng. Giải thích.
Lời giải:
Trong phản ứng oxi hoá - khử:
Chất khử mạnh + chất oxi hoá mạnh → Chất oxi hoá yếu + chất khử yếu
(Tính khử: Br- > Cl-)
(Tính khử: I- > Br-)
Vậy, tính khử của các ion được sắp xếp như sau: I- > Br- > Cl-.
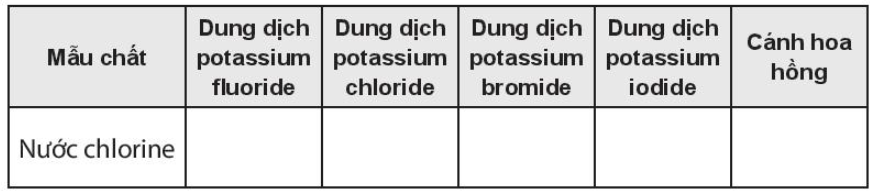
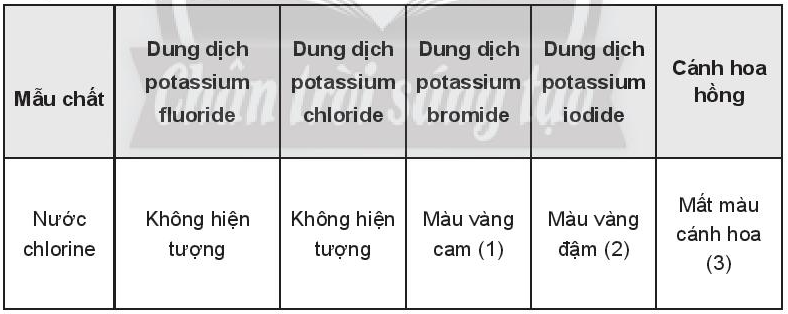
OT7.7 trang 83 SBT Hóa học 10. Ghi hiện tượng vào các ô trống trong bảng và viết phương trình hóa học của phản ứng (nếu có)
Lời giải:
Ghi hiện tượng vào các ô trống trong bảng và viết phương trình hoá họccủa phản ứng (nếu có)
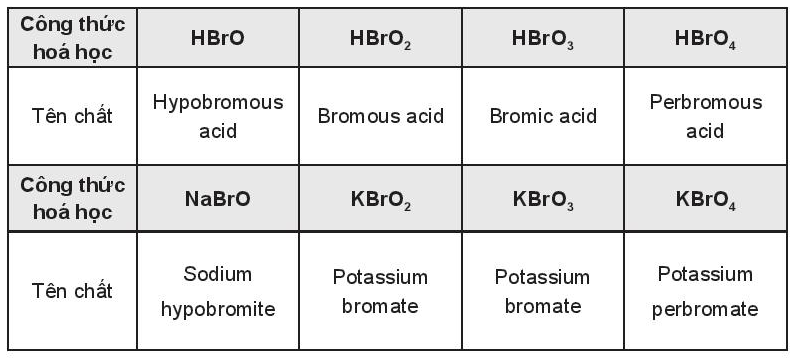
Acid có hậu tố -ous thì tạo muối có hậu tố -ite; acid có hậu tố -ic tạo muối có hậu tố -ate; acid có mức oxi hóa của nguyên tố trung tâm thấp nhất có tiền tố hypo-; acid có mức oxi hóa của nguyên tố trung tâm cao nhất có tiền tố per-. Áp dụng quy tắc trên, đọc tên các chất sau: HBrO; HBrO2; HBrO3; HBrO4; NaBrO; KBrO2; KBrO3 và KBrO4.
Lời giải:
Cách gọi tên theo bảng:
Lời giải:
Phương trình hoá học của phản ứng:
Từ hệ số cân bằng, ta có:
(mol)
Khối lượng CaCO3 trong mẫu đá vôi:
= 0,091 × 100 = 9,1 (g)
Hàm lượng CaCO3 trong mẫu đá vôi:
%CaCO3 =