Sách bài tập Hóa học 10 Bài 10 Chân trời sáng tạo: Liên kết cộng hóa trị
Với giải sách bài tập Hóa học 10 Bài 10: Liên kết cộng hóa trị sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 10.
Giải sách bài tập Hóa học lớp 10 Bài 10: Liên kết cộng hóa trị - Chân trời sáng tạo
Lời giải:
Đáp án đúng là: A
Nguyên tử N có 5 electron ở lớp ngoài cùng, nguyên tử N có xu hướng góp chung 3 electron với 3 nguyên tử H. Số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là 3.

Lời giải:
Đáp án đúng là: A
Nguyên tử chlorine có 7 electron hóa trị, hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp chung 1 electron tạo thành 1 cặp electron dùng chung.
Bài 10.3 trang 34 SBT Hóa học 10: Chất nào sau đây không có liên kết cộng hóa trị phân cực?
Lời giải:
Đáp án đúng là: A
Liên kết trong phân tử O2 là liên kết cộng hóa trị không phân cực.
Lời giải:
Đáp án đúng là: D
Phân tử C2F6 vừa có liên kết cộng hóa trị phân cực (liên kết giữa C và F), vừa có liên kết công hóa trị không phân cực (liên kết giữa C với C).
Sử dụng giá trị độ âm điện các nguyên tố được cho trong bảng sau để trả lời các câu 10.5, 10.6, 10.7.
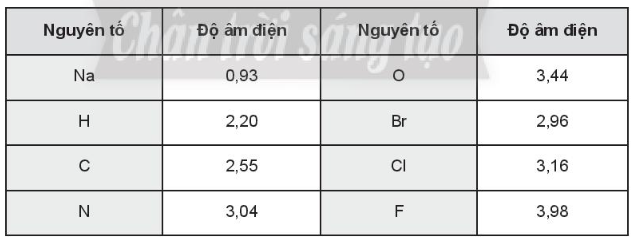
Bài 10.5 trang 34 SBT Hóa học 10: Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực?
Lời giải:
Đáp án đúng là: D
Liên kết C – H có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là (3,16 – 2,96) = 0,2 < 0,4 nên là liên kết cộng hóa trị không phân cực.
Lời giải:
Đáp án đúng là: A
Do nguyên tử H có độ âm điện nhỏ nhất nên lực kéo electron về phía nguyên tử nitrogen mạnh nhất ở liên kết N – H.
Bài 10.7 trang 35 SBT Hóa học 10: Liên kết nào trong các liên kết sau là phân cực nhất?
Lời giải:
Đáp án đúng là: B
Do nguyên tử F có độ âm điện lớn nhất nên liên kết C – F là phân cực nhất.
Lời giải:
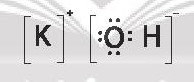
Đáp án đúng là: D
Hợp chất KOH chứa cả liên kết cộng hóa trị và liên kết ion.
B. 2 orbital s và 1 orbital p với nhau
C. 1 orbital s và 2 orbital với nhau
Lời giải:
Đáp án đúng là: D
Các liên kết trong phân tử nitrogen được tạo thành do sự xen phủ của 3 orbital p giống nhau về hình dạng và kích thước, chỉ khác nhau về sự định hướng trong không gian.
A. Các hợp chất cộng hóa trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
B. Các hợp chất cộng hóa trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
C. Các hợp chất cộng hóa trị đều dẫn điện tốt
D. Các hợp chất cộng hóa trị không phân cực tan được trong dung môi không phân cực.
Lời giải:
Đáp án đúng là: C
Phát biểu C sai vì các chất có liên kết cộng hóa trị không phân cực không dẫn điện ở mọi trạng thái, còn các chất có liên kết cộng hóa trị phân cực mạnh có thể dẫn điện.
Lời giải:
Đáp án đúng là: D
Cụ thể độ dài các liên kết theo đơn vị angstrom:
N – N: 1,45 angstrom;
N = N: 1,25 angstrom;
N ≡ N: 1,1 angstrom.
Bài 10.12 trang 35 SBT Hóa học 10: Phát biểu nào sau đây đúng với độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết
Lời giải:
Đáp án đúng là: C
Độ bền của liên kết tăng khi độ dài của liên kết giảm.
Lời giải:
Nguyên tử nitrogen có 5 electron ở lớp ngoài cùng, nguyên tử hydrogen có 1 electron ở lớp ngoài cùng. Khi hình thành liên kết trong phân tử NH3, nguyên tử nitrogen góp 3 electron, mỗi nguyên tử hydrogen góp 1 electron hình thành 3 cặp electron chung giữa nguyên tử nitrogen và 3 nguyên tử hydrogen như sau:
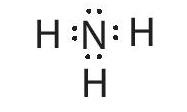
Lời giải:
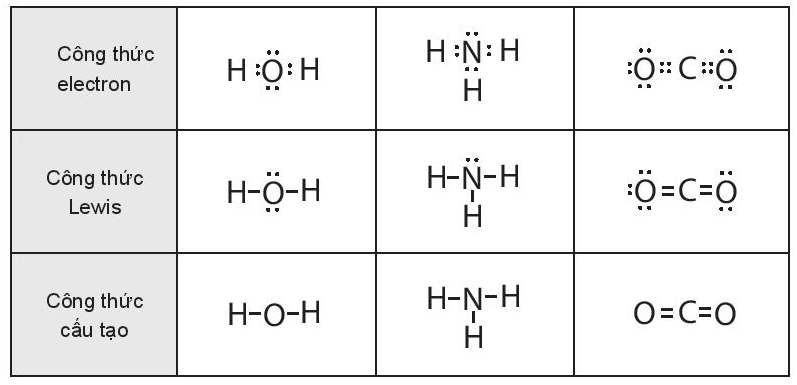
Lời giải:
Trong phân tử ozone có liên kết cho – nhận nên công thức Lewis và công thức cấu tạo của ozone lần lượt là:

Lời giải:
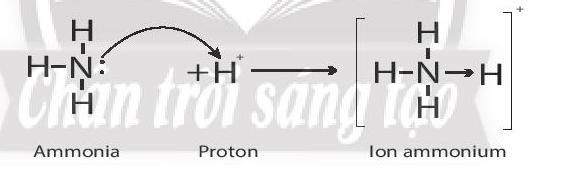
Liên kết cho – nhận trong ion ammonium:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có AO trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành NH4+. Khi đó, liên kết cho – nhận được hình thành, trong phân tử NH3, nguyên tử nitrogen là nguyên tử cho, ion H+ đóng vai trò nhận electron. Trong ion NH4+, bốn liên kết N – H hoàn toàn tương đương nhau:
Lời giải:
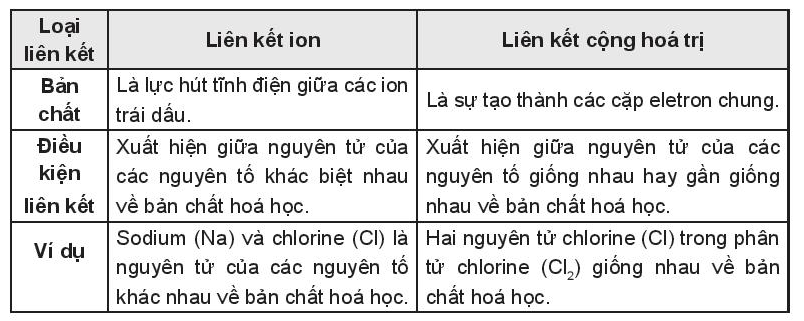
- Giống nhau: Liên kết ion và liên kết cộng hóa trị đều là nguyên nhân giúp các nguyên tử hình thành nên phân tử, trong đó các nguyên tử trong phân tử đều đạt được cơ cấu bền vững của khí hiếm gần nhất. Ví dụ:
+ Liên kết ion là nguyên nhân hình thành liên kết giữa nguyên tử sodium và nguyên tử chlorine để tạo nên phân tử sodium chloride. Trong phân tử sodium chloride các nguyên tử sodium và chlorine đều đạt cơ cấu bền vững giống khí hiếm.
+ Liên kết cộng hóa trị là nguyên nhân hình thành liên kết giữa hai nguyên tử chlorine tạo nên phân tử chlorine. Trong phân tử chlorine, nguyên tử Cl đã đạt cơ cấu bền vững giống khí hiếm.
- Khác nhau:
a. Viết công thức Lewis và công thức cấu tạo của H2S.
b. Em hiểu thế nào về nồng độ ppm của H2S trong không khí?
c. Một gian phòng trống (25oC; 1 bar) có kích thước 3m × 4m × 6m bị nhiễm 10 gam khí H2S. Tính nồng độ ppm của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này. Cho biết 1 mol khí ở 25oC và 1 bar có thể tích 24,79 L.
Lời giải:
a) Công thức Lewis và công thức cấu tạo của H2S:

b) Nồng độ ppm (parts per million – thành phần phần triệu) của H2S trong không khí là số lít khí H2S có trong 1 000 000 L không khí.
Ví dụ nếu trong 1000 lít không khí có lẫn 0,1 lít H2S thì trong 1000000 lít không khí có:
lít H2S.
Ta nói nồng độ ppm của H2S trong không khí là 100 ppm.
c) Thể tích không khí = thể tích gian phòng = 3 . 4 . 6 = 72 m3.
Thể tích của 10 gam H2S =
Trong 72 m3 không khí tức 72 000 lít không khí có 7,3 lít H2S nên trong 1000000 lít không khí có lít H2S.
Vậy nồng độ H2S trong gian phòng là 101,38 ppm nên gây kích thích màng phổi.
Lời giải:
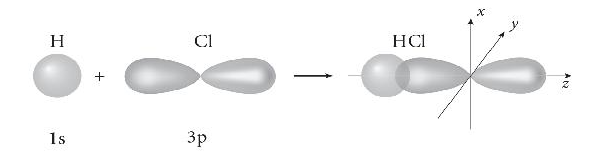
Sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 3p của nguyên tử chlorine trong sự hình thành liên kết σ trong phân tử hydrogen chloride (HCl):
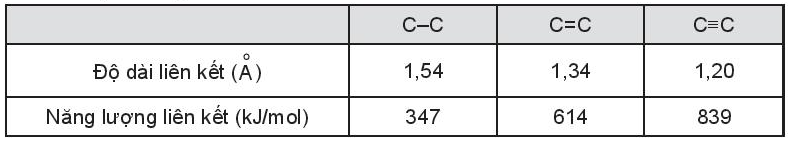
Lời giải:
Quan sát bảng ta thấy độ dài liên kết và năng lượng liên kết biến thiên tỉ lệ nghịch với nhau. Năng lượng liên kết càng lớn thì độ dài liên kết càng ngắn và ngược lại.
Lời giải:
Tuy có độ âm điện xấp xỉ nhau nhưng phân tử nitrogen có liên kết ba (N ≡ N), còn phân tử chlorine chỉ có liên kết đơn (Cl – Cl) nên phân tử nitrogen có năng lượng liên kết (945 kJ/ mol) lớn hơn nhiều so với phân tử chlorine (243 kJ/ mol), dẫn đến phải tiêu tốn năng lượng nhiều hơn để phá vỡ liên kết trong phân tử nitrogen so với trong phân tử chlorine. Vì vậy ở điều kiện thường, nitrogen kém hoạt động hơn nhiều so với chlorine.
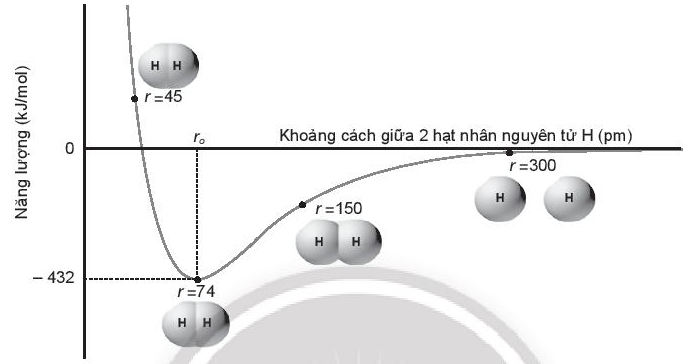
Cho biết năng lượng liên kết của phân tử hydrogen (H2) và độ dài liên kết H – H là bao nhiêu? Giải thích.
Lời giải:
Trên biểu đồ, năng lượng tối thiểu đại diện cho độ bền liên kết và khoảng cách ro tại mức năng lượng tối thiểu gọi là độ dài liên kết. Do đó phân tử H2 có năng lượng liên kết là 432 kJ/mol và có độ dài liên kết H – H là 74 pm.
Giải thích:
Sodium chloride là hợp chất ion nên chỉ tan trong dung môi phân cực là nước, không tan trong dung môi không phân cực là dầu hỏa.
Lời giải:
Benzene (C6H6) là hợp chất không phân cực nên benzene không tan trong dung môi phân cực (nước) mà tan tốt trong các dung môi không phân cực như tetrachloromethane (CCl4), hexane (C6H14), …
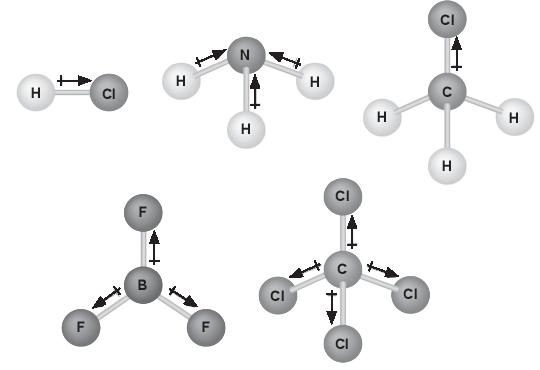
Bài 10.25* trang 37 SBT Hóa học 10: Biết phân tử BF3 có cấu trúc phẳng, phân tử CCl4 có cấu trúc hình tứ diện đều. Hãy cho biết có bao nhiêu phân tử phân cực và không phân cực trong hình dưới đây? Giải thích.
Lời giải:
- Ba phân tử đầu: HCl, NH3, CH3Cl đều là các phân tử phân cực, do tổng moment lưỡng cực không triệt tiêu.
- Hai phân tử sau: BF3, CCl4 đều là các phân tử không phân cực do tổng moment lưỡng cực triệt tiêu.
Bài 10.26* trang 38 SBT Hóa học 10:
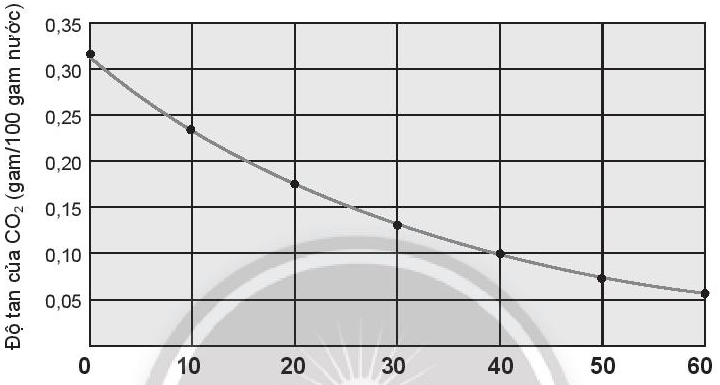
b. Nhận xét độ tan của carbon dioxide trong nước theo nhiệt độ dựa trên đồ thị sau:
c. Nước giải khát có gas là gì? Vì sao người ta thường ướp lạnh các loại nước giải khát có gas trước khi sử dụng.
d. Vì sao trong những ngày hè nóng bức, cá thường phải ngoi lên mặt nước để thở, trong khi vào mùa lạnh, điều này không xảy ra.
Lời giải:
a) Phân tử CO2 có dạng đường thẳng nên CO2 là phân tử không phân cực. Phân tử SO2 có dạng góc nên SO2 là phân tử phân cực. Như vậy, CO2 là phân tử không phân cực nên CO2 tan kém trong nước (là dung môi phân cực), trái với SO2 là phân tử phân cực nên SO2 tan nhiều trong nước.
b) Trên đồ thị, độ tan của CO2 trong nước giảm khi nhiệt độ tăng.
c) Nước giải khát có gas là nước giải khát được nạp khí CO2. Trong sản xuất, người ta nạp CO2 vào nước giải khát ở nhiệt độ thấp và áp suất cao để CO2 tan được nhiều hơn. Khi uống nước giải khát có gas, nhiệt độ cao trong dạ dày làm CO2 nhanh chóng theo đường miệng thoát ra ngoài, mang đi bớt một nhiệt lượng trong cơ thể làm người uống có cảm giác mát mẻ, dễ chịu.
Do CO2 tan tốt trong nước ở nhiệt độ thấp hơn nên để giữ lại lượng CO2 trong nước người ta thường ướp lạnh các loại nước giải khát trước khi sử dụng.
d) Oxygen là phân tử không phân cực nên khả năng hòa tan trong nước là dung môi phân cực cũng kém. Giống như độ hòa tan của carbon dioxide trong nước, độ tan của oxygen cũng giảm khi nhiệt độ tăng. Do đó vào mùa lạnh, cá có thể thở dễ dàng bằng lượng oxygen hòa tan trong nước, còn mùa hè lượng oxygen hòa tan trong nước ít hơn nên chúng thường ngoi lên mặt nước để thở.