Sách bài tập Hóa học 10 Chân trời sáng tạo: Ôn tập chương 3
Với giải sách bài tập Hóa học 10 Ôn tập chương 3 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Ôn tập.
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 3 - Chân trời sáng tạo
Bài OT3.1 trang 42 SBT Hóa học 10: Ion nào sau đây có cấu hình electron của khí hiếm helium?
Lời giải:
Đáp án đúng là: D
Ion Li3+ có cấu hình electron của khí hiếm helium.
Lời giải:
Đáp án đúng là: A
Li (Z = 3) có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm helium.
F (Z = 9) có 7 electron ở lớp ngoài cùng, có xu hướng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm neon.
Lời giải:
Đáp án đúng là: B
Phân tử BaCl2 và Na2O có sự liên kết giữa kim loại điển hình và phi kim điển hình nên chúng có liên kết ion.
Lời giải:
Đáp án đúng là: A
Trong số các phân tử Cl2, O2, CCl4, CO2 và SO2, các phân tử Cl2 và O2 không hình thành moment lưỡng cực, còn phân tử CCl4 có dạng tứ diện đều và phân tử CO2 có dạng đường thẳng nên phân tử CCl4 và CO2 có tổng các moment lưỡng cực bằng 0.
Vậy các phân tử Cl2, O2, CCl4, CO2 đều là các phân tử không cực.
Phân tử SO2 có dạng góc nên là phân tử có cực.
Lời giải:
Phân tử NaF và MgO có cùng 20 electron và khoảng cách giữa các hạt nhân là tương tự nhau (235pm và 215pm), tuy nhiên nhiệt độ nóng chảy của MgO cao hơn nhiều so với NaF, đó là do các ion magnesium và oxide mang điện tích lần lượt là +2 và -2 nên có lực hút tĩnh điện mạnh hơn nhiều so với các ion sodium và fluoride chỉ mang điện tích lần lượt là +1 và -1.
Lời giải:
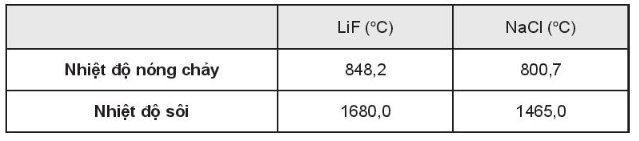
Lực hút tĩnh điện mạnh giữa các ion âm và ion dương làm cho LiF và NaCl đều có nhiệt độ nóng chảy và nhiệt độ sôi cao. Do các ion lithium và sodium đều mang điện tích +1, các ion fluoride và chloride đều mang điện tích -1 nên lực hút tĩnh điện ở đây phụ thuộc vào khoảng cách ion giữa các phân tử. Nếu các ion càng nhỏ, chúng càng gần nhau hơn dẫn đến lực hút tĩnh điện lớn hơn.
Do kích thước của ion Na+ lớn hơn ion Li+, kích thước ion Cl- lớn hơn ion F- nên lực hút tĩnh điện giữa các ion trong phân tử LiF lớn hơn trong phân tử NaCl làm nhiệt độ sôi và nhiệt độ nóng chảy của LiF cao hơn NaCl.
Bảng số liệu tham khảo:
Lời giải:
Công thức của Na2O2:
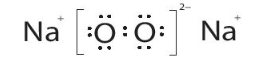
Trong phân tử Na2O2, liên kết giữa hai nguyên tử oxygen là liên kết cộng hóa trị không phân cực. Ngoài ra, mỗi nguyên tử sodium nhường 1 electron cho mỗi nguyên tử oxygen, hình thành nên các ion và Na+, những ion này hút nhau bằng lực hút tĩnh điện tạo nên phân tử Na2O2.
+ 2Na+ → 2Na2O2.
Lời giải:
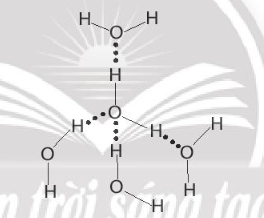
Liên kết hydrogen không phải là sự xen phủ giữa các AO, mà chỉ là lực hút tĩnh điện giữa nguyên tử hydrogen mang một phần điện tích dương đã liên kết với một nguyên tử có độ âm điện lớn (thường là N, O, F) với một nguyên tử có độ âm điện lớn khác (thường là N, O, F).
Ví dụ liên kết hydrogen giữa các phân tử nước:
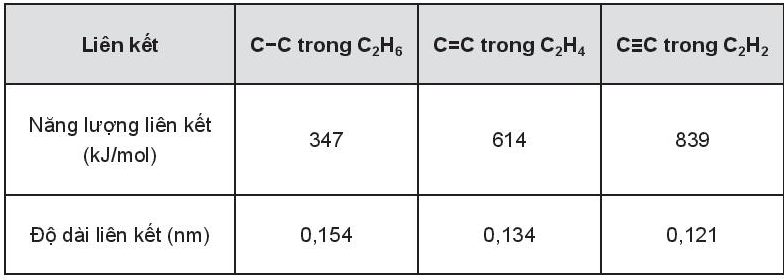
a. Nêu mối quan hệ giữa chiều dài liên kết và năng lượng liên kết giữa các nguyên tử carbon trong các hydrocarbon đã cho.
b. Giải thích vì sao giá trị năng lượng liên kết tăng theo thứ tự C – C, C = C, C ≡ C.
Lời giải:
a) Chiều dài liên kết tỉ lệ nghịch với năng lượng liên kết giữa các nguyên tử carbon trong các hydrocarbon đã cho.
b) Giá trị năng lượng liên kết tăng theo thứ tự C – C, C = C, C ≡ C do độ bền liên kết tăng theo thứ tự C – C, C = C, C ≡ C.
Lời giải:
Ethane (C2H6) và fluoromethane (CH3F) có kích thước tương đương nhau và đều có 18 electron. Như vậy, tương tác van der Waals giữa các phân tử trong hợp chất tương tự nhau dẫn đến nhiệt độ sôi của chúng lẽ ra phải tương tự nhau.
Tuy nhiên, C2H6 là phân tử không phân cực còn CH3F là phân tử phân cực nên độ sôi của CH3F cao hơn C2H6 khoảng hơn 10o.


