Sách bài tập Hóa học 10 Chân trời sáng tạo: Ôn tập chương 6
Với giải sách bài tập Hóa học 10 Ôn tập chương 6 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Ôn tập.
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 6 - Chân trời sáng tạo
Lời giải:
Đáp án đúng là: B.
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng:
Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì:
Vậy nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ giảm 4 lần.
A. 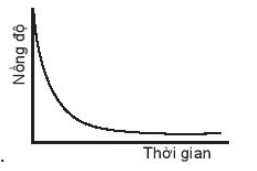
B. 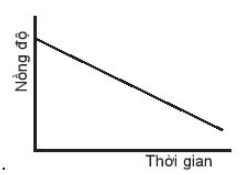
C. 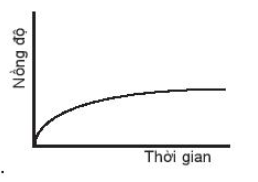
D. 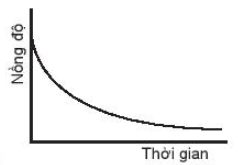
Lời giải:
Đáp án đúng là: A.
Đường cong nồng độ ở đồ thị A dốc nhất nên có tốc độ phản ứng nhanh nhất.
A. nồng độ
B. chất xúc tác
C. bề mặt tiếp xúc
D. nhiệt độ
Lời giải:
Đáp án đúng là: D.
Thanh đặt trong cốc nước nóng phát sáng hơn so với thanh đặt trong cốc nước lạnh.
Vậy yếu tố nhiệt độ đã ảnh hưởng đến tốc độ phản ứng.
Lời giải:
Trong hầu hết các phản ứng hóa học, tốc độ phản ứng tăng khi nhiệt độ tăng. Muốn pha một cốc trà đá có đường, bằng cách thêm đá viên và đường vào cốc trà nóng, thứ tự cho vào cốc trà nóng là đường, đá viên. Vì đường tan tốt hơn trong nước nóng.
OT6.5 trang 74 SBT Hóa học 10. Cho phương trình hóa học của phản ứng:
Lời giải:
Biểu thức tốc độ:, k là hằng số tốc độ phản ứng.
Khi nồng độ mol/L của CO và O2 là 1 M, thì: v = k × 12 × 1= k.
k là tốc độ riêng của phản ứng .
Lời giải:
Tính tốc độ trung bình (mL/s) của phản ứng trong 60 giây
OT6.7 trang 74 SBT Hóa học 10. Trong phản ứng: A → sản phẩm.
a. Tính tốc độ trung bình của phản ứng trong phút thứ nhất và trong phút thứ 2.
b. Nhận xét tốc độ phản ứng trong phút thứ nhất và phút thứ 2. Giải thích.
Lời giải:
a) Tốc độ trung bình của phản ứng trong phút thứ nhất:
Tốc độ trung bình của phản ứng trong phút thứ 2:
b) Tốc độ trung bình của phản ứng trong phút thứ nhất và phút thứ hai không bằng nhau, vì nồng độ chất A giảm theo thời gian, làm giảm số va chạm hiệu quả nên tốc độ phản ứng giảm.
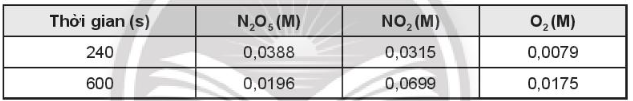
OT6.8 trang 74 SBT Hóa học 10. Xét phản ứng phân hủy N2O5 theo phương trình hóa học:
, xảy ra ở 56oC cho kết quả theo bảng:
Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
Lời giải:
Tốc độ trung bình của phản ứng được tính trong khoảng thời gian t1 = 240 (s) đến t2 = 600 (s) ⇒ ∆t = 600 – 240 = 360 (s); ∆C = Csau – Cđầu
Tốc độ trung bình của phản ứng
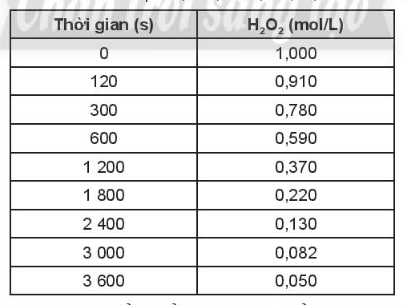
a. Tính tốc độ trung bình của phản ứng phân hủy H2O2 theo thời gian.
b. Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.
Lời giải:
a) Tốc độ phản ứng phân huỷ theo thời gian
|
Thời gian (s) |
H2O2 (mol/L) |
Tốc độ phản ứng (mol/L.s) |
|
0 |
1,000 |
0 |
|
120 |
0,910 |
7,5 × 10-4 |
|
300 |
0,780 |
7,3 × 10-4 |
|
600 |
0,590 |
6,8 × 10-4 |
|
1200 |
0,370 |
5,3 × 10-4 |
|
1800 |
0,220 |
4,3 × 10-4 |
|
2400 |
0,130 |
3,6 × 10-4 |
|
3000 |
0,082 |
3,1 × 10-4 |
|
3600 |
0,050 |
2,6 × 10-4 |
b) Tốc độ phản ứng giảm dần theo thời gian. Tốc độ phản ứng phụ thuộc vào nồng độ chất tham gia, theo thời gian, nồng độ H2O2 giảm dần nên tốc độ phản ứng giảm.