Sách bài tập Hóa học 10 Bài 8 Chân trời sáng tạo: Quy tắc Octet
Với giải sách bài tập Hóa học 10 Bài 8: Quy tắc Octet sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 8.
Giải sách bài tập Hóa học lớp 10 Bài 8: Quy tắc Octet - Chân trời sáng tạo
Bài 8.1 trang 28 SBT Hóa học 10: Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững
B. Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng
C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Lời giải:
Đáp án đúng là: A
Các nguyên tử liên kết với nhau thành phân tử để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
Lời giải:
Đáp án đúng là: C
Oxygen có cấu hình electron là: 1s22s22p4.
Oxygen có khuynh hướng nhận thêm 2 electron để đạt được cấu hình electron bền vững giống với khí hiếm neon (Ne).
Lời giải:
Đáp án đúng là: D
Sodium có cấu hình electron: 1s22s22p63s1
Khi tham gia hình thành liên kết hóa học, sodium có khuynh hướng nhường 1 electron để đạt được cấu hình electron giống với khí hiếm neon.
Lời giải:
Đáp án đúng là: A
Li (Z = 3): 1s22s1 khi tham gia hình thành liên kết hóa học Li có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững giống khí hiếm helium.
Cl (Z = 17): [Ne]3s23p5 khi tham gia hình thành liên kết hóa học Cl có xu hướng nhận 1 electron để đạt được cấu hình electron bền vững giống khí hiếm argon.
Lời giải:
Đáp án đúng là: D
H (Z = 1): 1s1 khi hình thành liên kết trong phân tử HBr, H đã đạt cấu hình electron bền của khí hiếm helium với 2 electron lớp ngoài cùng.
Br (Z = 35): [Ar]3d104s24p5 khi hình thành liên kết trong phân tử HBr, Br đã đạt cấu hình electron bền của khí hiếm krypton.
Lời giải:
Đáp án đúng là: A
Mg (Z = 12): [Ne]3s2
Khi hình thành liên kết hóa học Mg có xu hướng nhường (cho) đi 2 electron để đạt được cấu hình electron bền vững giống khí hiếm.
Lời giải:
Đáp án đúng là: D
Có 4 nguyên tử trong các phân tử đã cho đạt cấu hình electron bền vững của khí hiếm neon là O, Na, F và C.
Bài 8.8 trang 29 SBT Hóa học 10: Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Lời giải:
Đáp án đúng là: D
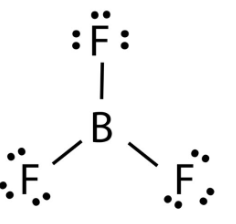
Trong phân tử BF3, nguyên tử B mới chỉ có 6 electron ở lớp ngoài cùng, chưa đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Lời giải:
Nguyên tử oxygen đạt được cấu hình electron bền của khí hiếm Ne trong MgO (chất rắn); H2O (chất lỏng) và O2 (chất khí).
Lời giải:
K (Z = 19): [Ar]4s1 → có xu hướng nhường 1 electron khi hình thành liên kết hóa học.
I (Z = 53): [Kr]4d105s25p5 → có xu hướng nhận 1 electron khi hình thành liên kết hóa học.
Trong phân tử potassium iodide (KI), nguyên tử K và I lần lượt đạt cơ cấu bền của khí hiếm gần nhất là Ar (argon) và Xe (xenon).


