Giải Hoá 10 (Chân trời sáng tạo) Bài 8: Quy tắc octet
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 8: Quy tắc octetsách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 8. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 8: Quy tắc octet
Video giải Hóa lớp 10 Bài 8: Quy tắc octet
Lời giải:
Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
1. Liên kết hóa học
Lời giải:
- Sự hình thành phân tử H2:
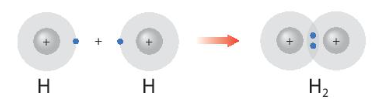
Sau khi tham gia liên kết nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng giống cấu hình electron của He.
- Sự hình thành phân tử F2:
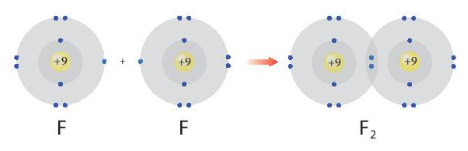
Sau khi hình thành liên kết Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng giống cấu hình electron của Ne.
Lời giải:
- Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung, khi đó mỗi nguyên tử chlorine sẽ đạt được cấu hình electron bền vững.
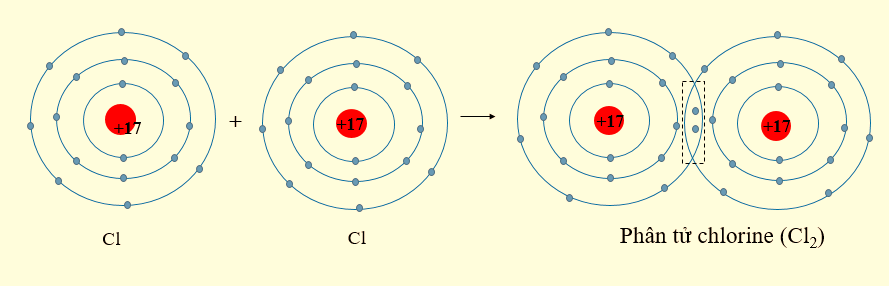
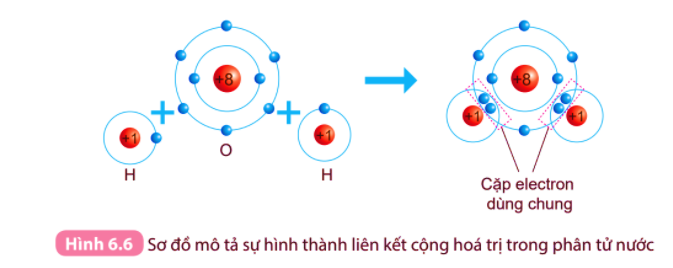
- Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung, khi đó mỗi nguyên tử oxygen sẽ đạt được cấu hình electron bền vững.
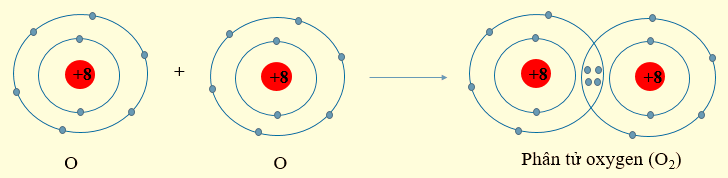
2. Quy tắc octet
Lời giải:
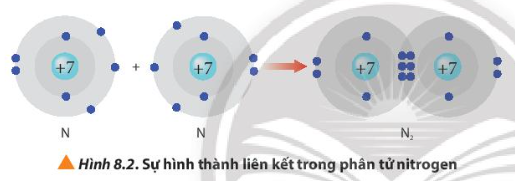
Sau khi hình thành liên kết, mỗi nguyên tử nitrogen có 2 lớp electron và có 8 electron ở lớp ngoài cùng. Vậy mỗi nguyên tử nitrogen đạt được cấu hình electron bền vững của nguyên tử khí hiếm neon.
Lời giải:
Fluorine có 7 electron lớp ngoài cùng, hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron).
Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ góp chung 1 electron hóa trị để tạo thành cặp electron dùng chung.
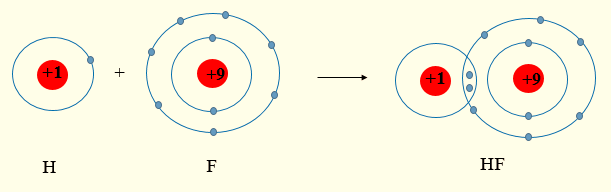
Lời giải:
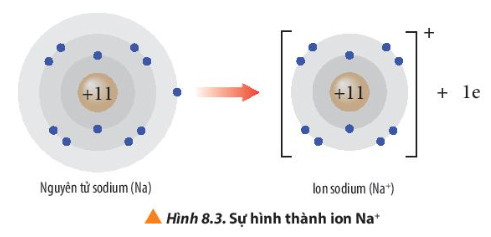
- Ion sodium có 2 lớp electron và có 8 electron ở lớp ngoài cùng giống cấu hình electron của khí hiếm neon.
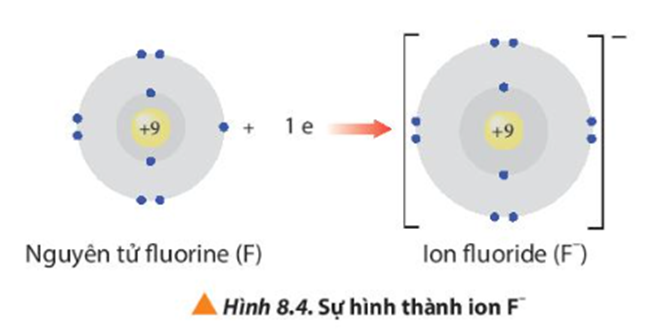
- Ion fluoride có 2 lớp electron và có 8 electron ở lớp ngoài cùng giống cấu hình electron của khí hiếm neon.
Lời giải:
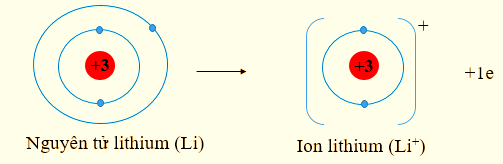
Lithium có số hiệu nguyên tử: Z = 3 ⇒ Cấu hình electron: 1s22s1
⇒ Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He. Phần tử thu được mang điện tích dương, gọi là ion lithium, kí hiệu Li+.
Lời giải:
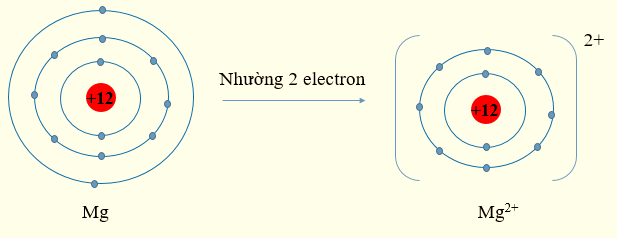
- Sự hình thành ion Mg2+:
Nguyên tử Mg có Z = 12, cấu hình electron: 1s22s22p63s2
Nguyên tử Mg có 2 electron lớp ngoài cùng có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm. Khi đó, phần tử thu được mang điện tích dương, kí hiệu Mg2+.
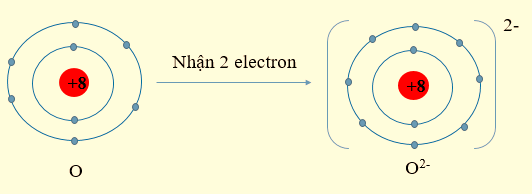
- Sự hình thành ion O2-
Nguyên tử O có Z = 8, cấu hình electron: 1s22s22p4
Nguyên tử O có 6 electron lớp ngoài cùng có xu hướng nhận 2 electron tạo thành ion O2- đạt cấu hình electron bền vững của khí hiếm:
Bài tập (trang 54)
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Lời giải:
Đáp án đúng là: D
Cấu hình electron chlorine (Z = 17): 1s22s22p63s23p5 ⇒ Cl có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Lời giải:
Đáp án đúng là: C
Cấu hình electron potassium: 1s22s22p63s23p64s1.
Potassium có 1 electron lớp ngoài cùng có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6.
Lời giải:
- Nguyên tử K (cấu hình electron: 1s22s22p63s23p64s1) có 1 electron lớp ngoài cùng, có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm. Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+.
- Nguyên tử Cl (cấu hình electron: 1s22s22p63s23p5) có 7 electron lớp ngoài cùng, có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm. Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
- Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
- Sơ đồ mô tả:
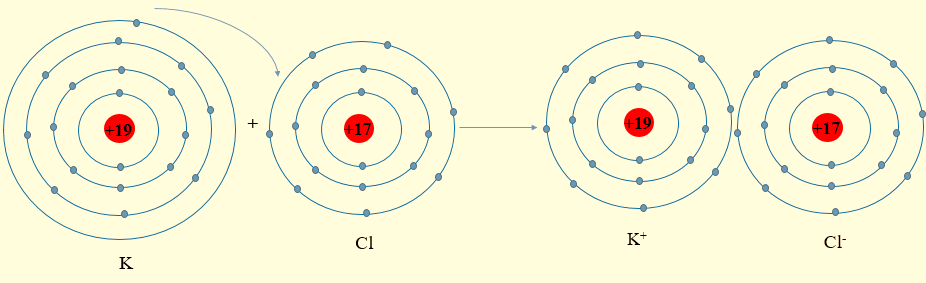
Lời giải:
- Nguyên tử O (cấu hình electron: 1s22s22p4) có 6 electron lớp ngoài cùng, có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (cấu hình electron: 1s1) có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O tạo thành 2 cặp electron dùng chung.