Giải Hoá 10 (Chân trời sáng tạo) Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 5. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Video giải Hóa lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc:
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử và cấu hình electron tương tự nhau được xếp cùng một chu kì.
- Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
⇒ Biết cấu hình electron nguyên tử có thể xác định được vị trí nguyên tố trong bảng tuần hoàn và ngược lại.
1. Lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Bảng tuần hoàn các nguyên tố hóa học của Mendeleev gồm kí hiệu các nguyên tố hóa học và khối lượng nguyên tử của chúng.
Cách sắp xếp các nguyên tố theo Mendeleev: Các nguyên tố được sắp xếp vào các hàng và các cột theo chiều tăng dần khối lượng nguyên tử, bắt đầu mỗi hàng khi tính chất của nguyên tố bắt đầu lặp lại.
Lời giải:
Quan sát hai nguyên tố Te và I trong Hình 5.1 ta thấy: Nguyên tố Te có khối lượng nguyên tử (bằng 128) lớn hơn khối lượng nguyên tử I (bằng 127) nhưng được xếp trên I.
Lời giải:
Các dấu chấm hỏi trong bảng tuần hoàn ở hình 5.1 (cụ thể 10 dấu chấm hỏi) là các dự đoán của Mendeleev về các nguyên tố mới (gồm 10 nguyên tố). Trong đó có 3 nguyên tố (sau này chính là Sc; Ga và Ge) được ông miêu tả khá tỉ mỉ về tính chất vật lí của đơn chất và một số hợp chất của chúng, 7 nguyên tố còn lại do vị trí của chúng trong bảng tuần hoàn không thuận lợi cho việc tiên đoán, nên ông mới chỉ ước lượng được khối lượng nguyên tử của chúng.
Lời giải:
- Dựa vào bảng tuần hoàn (Hình 5.2) ta thấy:
+ Sc có khối lượng nguyên tử bằng 44,96 (≈ 45) ⇒ Trong bảng tuần hoàn của Mendeleev (Hình 5.1) Sc nằm giữa Ca (khối lượng nguyên tử bằng 40) và Er (khối lượng nguyên tử bằng 56).
+ Ga có khối lượng nguyên tử bằng 69,72 và đứng ngay sau Al, cạnh Zn ⇒ Trong bảng tuần hoàn của Mendeleev (Hình 5.1) Ga được dự đoán có khối lượng nguyên tử bằng 68 và nằm ngay dưới Zn (khối lượng nguyên tử bằng 65,2), cạnh Al.
+ Ge có khối lượng nguyên tử bằng 72,64 ⇒ Trong bảng tuần hoàn của Mendeleev (Hình 5.1) Ge được dự đoán có khối lượng nguyên tử bằng 70, nằm ngay trên As (khối lượng nguyên tử bằng 75) và nằm dưới Ga.
2. Bảng tuần hoàn các nguyên tố hóa học
Lời giải:
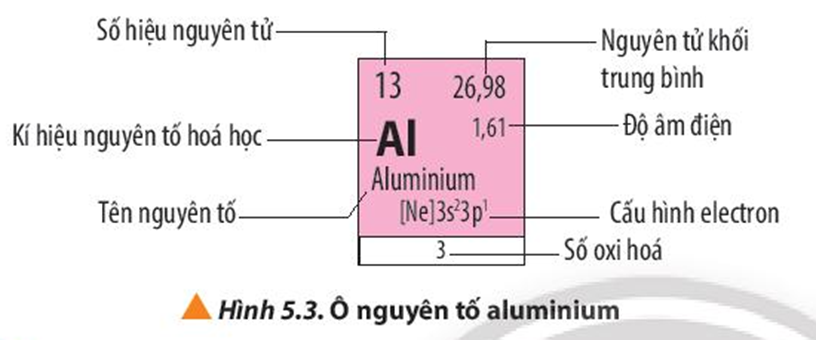
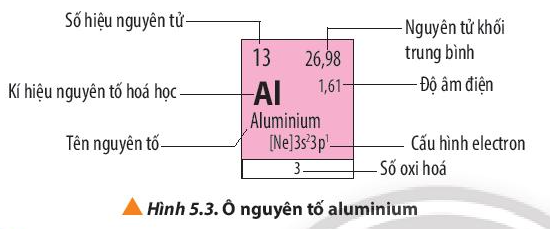
Các thông tin có trong ô nguyên tố aluminium:
Số hiệu nguyên tử: 13
Kí hiệu hóa học: Al
Tên nguyên tố: Aluminium
Nguyên tử khối trung bình: 26,98
Độ âm điện: 1,61
Cấu hình electron: [Ne]3s23p1
Số oxi hóa: 3
Lời giải:
Dựa vào cấu hình electron xác định nguyên tử aluminium có 3 electron lớp ngoài cùng.
Dựa vào số hiệu nguyên tử (Z) = 13, xác định nguyên tử aluminium có 13 electron.
Lời giải:
Các nguyên tố thuộc chu kì 2 đều có 2 lớp electron.
Các nguyên tố thuộc chu kì 3 đều có 3 lớp electron.
⇒ Các nguyên tố trong cùng chu kì có cùng số lớp electron trong nguyên tử.
Lời giải:
Cấu hình electron nguyên tử của nguyên tố có Z = 20 là: 1s22s22p63s23p64s2
⇒ Số thứ tự chu kì = số lớp electron = 4.
Lời giải:
Các nguyên tố trong cùng một nhóm A có số electron lớp ngoài cùng bằng nhau.
Lời giải:
Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (từ IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột.
Lời giải:
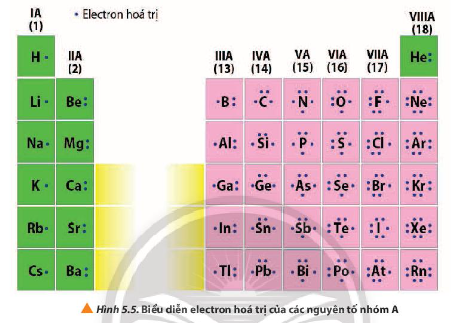
Với các nguyên tố nhóm A: Số electron hóa trị của nguyên tử bằng số thứ tự nhóm.
Lời giải:
Các nguyên tố nhóm B: Số thứ tự của nhóm bằng tổng số electron thuộc hai phân lớp (n -1)d và ns. Nếu tổng số electron trên hai phân lớp này của nguyên tử là 8, 9, 10 thì nguyên tố đó thuộc nhóm VIIIB; là 11 thì thuộc nhóm IB; là 12 thì thuộc nhóm IIB.
Lời giải:
|
Số hiệu nguyên tử |
Cấu hình electron |
Khối nguyên tố |
Tính chất |
|
6 |
1s22s22p2 |
p |
Phi kim |
|
8 |
1s22s22p4 |
p |
Phi kim |
|
18 |
1s22s22p63s23p6 |
p |
Khí hiếm |
|
20 |
1s22s22p63s23p64s2 |
s |
Kim loại |
a) Viết cấu hình electron của nitrogen
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Lời giải:
a) Cấu hình electron của nitrogen: 1s22s22p3 hay [He] 2s22p3.
b) Nitrogen thuộc nhóm VA ⇒ nitrogen là nguyên tố p.
Hoặc dựa vào cấu hình electron lớp ngoài cùng có dạng ns2npa xác định.
c) Nitrogen có 5 electron lớp ngoài cùng ⇒ là phi kim.
Lời giải:
+ Trong một chu kì, theo chiều từ trái sang phải, điện tích hạt nhân tăng dần;
+ Trong một nhóm, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng dần;
Lời giải:
Cấu hình electron của nguyên tố silicon (Z = 14): 1s22s22p63s23p2 hay [Ne]3s23p2.
Vậy silicon ở:
+ Ô thứ 14 do Z = 14;
+ Chu kì 3 do có 3 lớp electron;
+ Nhóm IVA do có 4 electron lớp ngoài cùng, nguyên tố p.
Bài tập (trang 42)
Lời giải:
a) Cấu hình electron Ne (Z = 10): 1s22s22p6
+ Ne thuộc khối nguyên tố p;
+ Ne có 8 electron lớp ngoài cùng ⇒ là khí hiếm.
b) Cấu hình electron của Mg (Z = 12): 1s22s22p63s2 hay [Ne]3s2.
+ Mg thuộc khối nguyên tố s;
+ Mg có 2 electron lớp ngoài cùng ⇒ là kim loại.
Bài 2 trang 42 Hóa học 10: Dãy nào gồm các nguyên tố có tính chất hóa học tương tự nhau? Vì sao?
a) Oxygen (Z = 8), nitrogen (Z = 7), carbon (Z = 6).
b) Lithium (Z = 3), sodium (Z = 11), potassium (Z = 19).
c) Helium (Z = 2), neon (Z = 10), argon (Z = 18).
Lời giải:
Dãy (b) và (c) gồm các nguyên tố có tính chất hóa học tương tự nhau.
Giải thích: Các nguyên tố thuộc cùng một nhóm trong bảng tuần hoàn có tính chất hóa học tương tự nhau:
+ Dãy (b) gồm các nguyên tố thuộc nhóm IA;
+ Dãy (c) gồm các nguyên tố thuộc nhóm VIIIA.
Bài 3 trang 42 Hóa học 10: Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA
b) Nguyên tố khí hiếm thuộc chu kì 3
Lời giải:
a) Nguyên tố thuộc chu kì 4 ⇒ có 4 lớp electron
Thuộc nhóm IIA ⇒ Có 2 electron lớp ngoài cùng, nguyên tố s.
⇒ Cấu hình electron nguyên tử của nguyên tố đó là: 1s22s22p63s23p64s2 hay [Ar]4s2.
b) Nguyên tố khí hiếm ⇒ Thuộc nhóm VIIIA
Thuộc chu kì 3 ⇒ Có 3 lớp electron
⇒ Cấu hình electron nguyên tử của nguyên tố đó là: 1s22s22p63s23p6.